Chronische Lymphatische Leukämie (Stand Jan 2012)
Erstellung der Leitlinie
Stand: Januar 2012
1 Definition und Basisinformationen
Die WHO-Klassifikation beschreibt die chronische lymphatische Leukämie (CLL) als indolentes (lymphozytisches) Lymphom, das durch einen leukämischen Verlauf charakterisiert ist. Nach WHO ist die CLL dabei immer eine B-Zell-Neoplasie, während die früher als T-CLL bezeichnete Entität nun T-Prolymphozytenleukämie (T-PLL) heißt.
1.1 Häufigkeit
Die CLL ist die häufigste leukämische Erkrankung in der westlichen Hemisphäre. In Deutschland erkranken jährlich etwa 2.250 Männer und 1.500 Frauen. Die altersstandardisierte Neuerkrankungsrate liegt für Männer bei 4,1, für Frauen bei 2,1 pro 100.000 Einwohner. Das mediane Alter bei Erstdiagnose liegt für Männer bei 70, für Frauen bei 72 Jahren, siehe Abbildung 1.
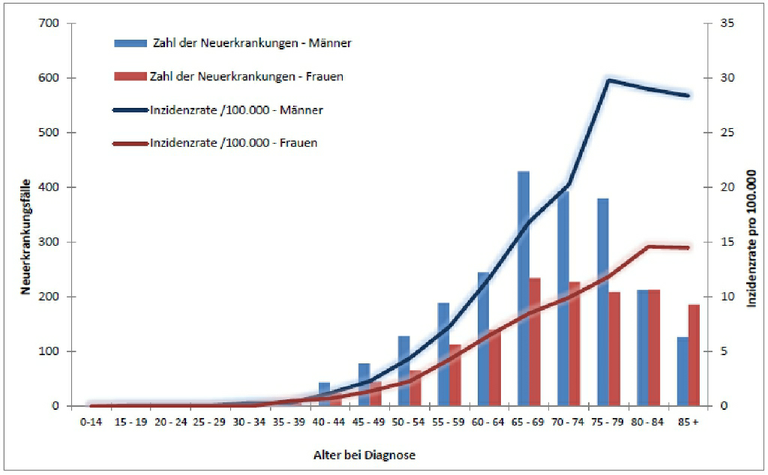
Hochrechnung des Instituts für Krebsepidemiologie e.V., Lübeck für ICD10: C91.1 auf Basis der Neuerkrankungsdaten der Krebsregister Bremen, Hamburg, Niedersachsen, Münster, Saarland (für ICD 9: 204.1) und Schleswig-Holstein in den Jahren 2007/8 (Bezugsbevölkerung ≈ 16 Millionen Einwohner), September 2011
Quelle: Ulrich Gerdemann, Ron Pritzkuleit, Alexander Katalinic, Institut fürKrebsepidemiologie e.V., Lübeck
1.2 Risikofaktoren
Das Risiko, an einer CLL zu erkranken, wird durch folgende Faktoren erhöht:
erworben
organische Lösungsmittel
genetisch
Personen mit einer positiven Familien-Anamnese haben ein erhöhtes Risiko für die Diagnose einer CLL oder einer anderen lymphatischen Neoplasie.
Der CLL geht meist ein nicht diagnostiziertes, klinisch asymptomatisches Vorstadium mit Vermehrung klonaler B Zellen voraus. Diese haben die biologischen Merkmale leukämischer Zellen und werden als Monoklonale B Lymphozytose (MBL) bezeichnet. Bei > 5 % der über 60 Jährigen ist eine MBL nachweisbar. Das Risiko der Transformation in eine behandlungsbedürftige CLL beträgt etwa 1 % / Jahr.
2 Vorbeugung und Früherkennung
Es gibt keine Evidenz für wirksame Maßnahmen zur Vorbeugung und Früherkennung.
3 Klinisches Bild
Die Erkrankung ist durch eine Blut-Lymphozytose charakterisiert, welche häufig zufällig festgestellt wird. Mit Fortschreiten der Erkrankung treten Lymphadenopathie, Spleno- und Hepatomegalie, Zeichen der Knochenmarkinsuffizienz und evtl. Autoimmun-Zytopenien auf. Klinische Beschwerden können sich ferner im Sinne von B-Symptomen und einer vermehrten Infektneigung manifestieren.
4 Diagnose
4.1 Diagnose - Kriterien
Nach den Kriterien desInternational Workshop on CLL (IWCLL) 2008wird die Diagnose einer CLL durch die Erfüllung der folgenden Kriterien definiert:
Nachweis von mindestens 5000 klonalen B-Lymphozyten pro μl im peripheren Blut. Unterhalb dieses Wertes kann die „Diagnose“ Monoklonale B-Lymphozytose (ungewisser Signifikanz) („MBL“) gestellt werden, wenn keine Krankheitszeichen (B Symptome, Lymphadenopathie, Hepatomegalie, Splenomegalie, Zytopenie etc.) vorliegen.
Vorherrschen kleiner, morphologisch reif wirkender Lymphozyten in der zytologischen Untersuchung des Blutausstrichs
Koexpression der B-Zell-Antigene CD19, CD20, und CD23 mit dem T Zell-Antigen CD5 in der multiparametrischen Immunphänotypisierung. Zusätzlich charakteristisch ist die relativ schwache Expression von Oberflächenimmunglobulin, CD20 und CD79b. Durch die Leichtkettenrestriktion (Ig kappa oder Ig lambda ), vorzugsweise durch Doppelmarkierung von CD19/kappa oder CD19/lambda, kann die Monoklonalität der Zellen bewiesen werden.
Charakteristische Befunde der Mikroskopie, der Immunphänotypisierung und der Genetik sind in der Wissensdatenbank Chronische Lymphatische Leukämie dargestellt, https://www.onkopedia.com/wissensdatenbank/wissensdatenbank/chronische-lymphatische-leukaemie-cll.
4.2 Diagnostik
Das diagnostische Vorgehen richtet sich nach der primären Befundkonstellation, in der Regel charakterisiert durch den Leitbefund Lymphozytose mit oder ohne begleitende Lymphadenopathie.Besteht bei einem Patienten der Verdacht auf eine CLL, so werden folgende Untersuchungen empfohlen, siehe Tabellen 1 und 2.
Untersuchung | Anmerkungen |
Anamnese | Leistungsschwäche, B-Symptome, Infektneigung etc., frühere Blutbilder / Leukozytenwerte, Familienanamnese |
körperliche Untersuchung | Lymphknotenstatus, Organomegalie, Blutungs- und Anämiezeichen |
Blutbild | Leukozyten mit Differenzialblutbild, Thrombozyten, Hämoglobin, Retikulozyten (bei Anämiezeichen) |
multiparametrische Immunphänotypisierung |
|
Knochenmarkpunktion | in der Regel zur Diagnosestellung nicht erforderlich, kann aber im Krankheitsverlauf zur Beurteilung unklarer Zytopenien bzw. der Remissionsqualität angezeigt sein |
Lymphknotenbiopsie | nur bei fehlender leukämischer Ausschwemmung oder Verdacht auf Transformation in ein aggressives Lymphom angezeigt (Richter Syndrom) |
Untersuchung | Anmerkungen |
Genetik |
|
weitere Laboranalysen | In Abhängigkeit von Symptomatik und geplanter Therapie, z. B.
|
Sonographie | Abdomen: Lymphknoten |
Anmerkungen: * Die Daten zur ungünstigen Prognose von Patienten mit Deletion 17p13 beruhen auf molekular-zytogenetischen Analysen mittels FISH. Das Kollektiv von Patienten mit Inaktivierung von p53 durch Mutationen überlappt sehr stark mit dem der Patienten mit Deletion 17p13, ist aber nicht völlig deckungsgleich. Zum jetzigen Zeitpunkt wird deshalb als Standard die FISH Analyse auf Deletion 17p13 empfohlen.
In jüngerer Zeit identifizierte biologische Prognosefaktoren wie Thymidinkinase, Beta-2-Mikroglobulin,Mutationsstatus der variablen Segmente der Immunglobulinschwerketten-Gene (IGHV), weitere genomische Aberrationen, CD38 oder ZAP70-Expression bedürfen weiterhin der prospektiven Validierung und sind derzeit nicht Grundlage differenzialtherapeutischer Überlegungen außerhalb klinischer Studien. Ihre routinemäßige Bestimmung ist außerhalb klinischer Studien nicht indiziert.
4.3 Stadieneinteilung und Prognosefaktoren
Für die Stadieneinteilung nach Binet (in Europa die gebräuchlichere, siehe Tabelle 3) oder Rai sind lediglich eine körperliche Untersuchung sowie eine Blutbildanalyse notwendig. Die Ergebnisse apparativer Untersuchungen (Organomegalie in Sonografie, CT) sind für die Stadieneinteilung nicht relevant.
Stadium | Definition | Medianes Überleben |
A | Hämoglobin>10 g / dl Thrombozyten>100.000 / µl < 3 betroffene Regionen2(LK1, Leber oder Milz) | > 10 Jahre |
B | Hämoglobin>10 g / dl Thrombozyten>100.000 / µl >3 betroffene Regionen2(LK1, Leber oder Milz) | 5 Jahre |
C | Hämoglobin < 10 g / dl Thrombozyten < 100.000 / µl | 2 - 3 Jahre |
1LK = Lymphknoten;2zu den Regionen zählen zervikale, axilläre, inguinale LK-Vergrößerungen (unilateral oder bilateral), sowie Leber und Milzvergrößerungen (Erfassung nur durch körperliche Untersuchung).
4.4 Differenzialdiagnose
Die häufigsten Differenzialdiagnosen sind:
monoklonale B Lymphozytose
reaktive Lymphozytose (virale Infekte, Kollagenosen)
andere leukämisch verlaufende Lymphome (follikuläres Lymphom sieheLeitlinie Follikuläres Lymphom,lymphoplasmozytisches Lymphom, Marginalzonenlymphom sieheLeitlinie Marginalzonenlymphom, Mantelzelllymphom sieheLeitlinie Mantelzelllymphom, B-Prolymphozyten-Leukämie (B-PLL)).
Haarzell-Leukämie, sieheLeitlinie Haarzell-Leukämie
4.5 Therapie
Die CLL ist durch konventionelle Chemotherapie sowie durch Antikörper-basierte Therapien nach derzeitigem Kenntnisstand nicht heilbar. Die einzige kurative Option besteht in der allogenen Stammzelltransplantation.
Eine Therapieindikation besteht allgemein im Stadium Binet C sowie im Stadium Binet B oder A, wenn weitere Kriterien für eine Therapiepflichtigkeit erfüllt sind:
Auftreten/Verschlechterung einer Anämie / Thrombozytopenie
massive (> 6 cm unter dem Rippenbogen), progrediente oder symptomatische Splenomegalie; Anmerkung: die Milzgröße ist individuell variabel in Abhängigkeit von Körpergröße und -gewicht
massive (> 10 cm im Durchmesser), progrediente oder symptomatische Lymphadenopathie
Lymphozytenverdopplungszeit von weniger als 6 Monaten oder 50 % Anstieg in 2 Monaten nach Ausschluss anderer Ursachen für eine Lymphozytose
auf Standardtherapie refraktäre Autoimmunzytopenie
eines der folgenden konstitutionellen Symptome
ungewollter Gewichtsverlust > 10 % in 6 Monaten
Fieber unklarer Ursache für mehr als 2 Wochen
Nachtschweiß über mehr als einen Monat ohne Nachweis einer Infektion
schwerwiegende Fatigue
5 Therapie
5.1 Erstlinientherapie
Die Therapiewahl sollte bei der CLL an der Komorbidität (ermittelt z.B. durch den CIRS Score), am genetischen Status, an der Nierenfunktion und weniger am kalendarischen Alter ausgerichtet sein, siehe Abbildung 2. Wenn immer möglich, soll die Therapie im Rahmen klinischer Studien erfolgen.
 palliativer Therapieansatz;
palliativer Therapieansatz; kurativer Therapieansatz;
kurativer Therapieansatz;
* zur Methodik siehe Kapitel 4.1.2. Diagnostik; ** allo SZT bei Patienten, die hierfür geeignet sind;
A - Alemtuzumab, allo SZT - allogene Stammzelltransplantation, B - Bendamustin, BSC - Best Supportive Care, C - Cyclophosphamid, Clb - Chlorambucil, C - Cyclophosphamid, CR - komplette Remission, F - Fludarabin, P - Prednison, PD - Progress, PR - partielle Remission, R - Rituximab, SD - stabile Erkrankung, w & w - abwartendes Verhalten;
Bei körperlich fitten Patienten (z.B. CIRS < 6) mit normaler Nierenfunktion und Fehlen einer klinisch relevanten Komorbidität besteht die Erstlinientherapie der Wahl außerhalb klinischer Studien in der Kombinationstherapie Fludarabin, Cyclophosphamid plus Rituximab (FCR), sieheChronische Lymphatische Leukämie - medikamentöse Tumortherapie.
Eine Alternative zu FCR kann die Kombination von Bendamustin mit Rituximab (BR) sein, insbesondere bei unkontrollierter Autoimmunhämolyse oder eingeschränkter Nierenfunktion. Allerdings liegen für diese Kombination bislang nur Daten aus einarmigen Phase II Studien vor. Ergebnisse einer Studie, die BR im randomisierten Vergleich zu FCR in der Erstlinientherapie untersucht hat, stehen derzeit noch aus.
Für Patienten mit eingeschränkter Nierenfunktion und/oder erhöhter Komorbidität stehen mindestens zwei Optionen zur Verfügung, Chlorambucil bzw. Bendamustin. Im direkten Vergleich hat sich Bendamustin gegenüber Chlorambucil hinsichtlich ORR, CR und PFS überlegen gezeigt. Die Monotherapie mit Chlorambucil sollte dem durch Begleiterkrankungen beeinträchtigten Patienten vorbehalten bleiben. Die Hinzunahme von Rituximab zu Bendamustin oder Chlorambucil verbessert nach Daten aus Phase II Studien deren Wirksamkeit. Es laufen derzeit Phase III Studien zu dieser Fragestellung, so dass diese Kombination zukünftig auch für Patienten mit Komorbiditäten eine Option darstellen könnte.
Eine Monotherapie mit Fludarabin in Standarddosierung wird aufgrund seiner erhöhten Toxizität bei gleichzeitig nicht verbesserten Überlebensparametern im Vergleich zu einer Chlorambucil-Therapie bei komorbiden Patienten nicht empfohlen.
Als Standard orientieren sich die Dosierungen von Chemo- und Immuntherapien an den Vorgaben multizentrischer Studien. Bei älteren und komorbiden CLL-Patienten kann eine Dosisreduktion erforderlich sein, gelegentlich bei der ersten Gabe, häufiger im Verlauf weiterer Therapiezyklen als Anpassung an die individuelle Sensitivität.
Patienten mit Nachweis einer 17p13 Deletion bzw. einer p53 Mutation haben eine niedrigere Ansprechrate und kürzeres Progressionsfreies sowie Gesamt-Überleben nach Chemotherapie (Chlorambucil, Fludarabin-haltige Schemata, Bendamustin, auch in Kombination mit Rituximab). Bei Patienten ohne relevante Komorbidität mit therapiepflichtiger CLL und Deletion 17p13 sollten alternative Therapieansätze (z.B. Alemtuzumab mit nachfolgender konsolidierender allogener Blutstammzelltransplantation), wenn möglich im Rahmen klinischer Studien, angestrebt werden, da damit ein langfristiges krankheitsfreies Überleben erreicht werden kann.
5.2 Medikamente
Informationen über den Zulassungsstatus der für die Therapie der CLL geeigneten Medikamente sind inChronische Lymphatische Leukämie Zulassungsstatusfür Deutschland, Österreich und die Schweiz aufgeführt.
5.3 Zweitlinientherapie
Die Auswahl der Rezidivtherapie hängt von individuellen Faktoren ab. Dies sind neben Alter und Komorbidität des Patienten vor allem klinische Parameter wie die Art der Primärtherapie und die damit erreichte Remissionsdauer. Ein Algorithmus ist in Abbildung 3 dargestellt. Wenn immer möglich, soll die Therapie im Rahmen klinischer Studien erfolgen.
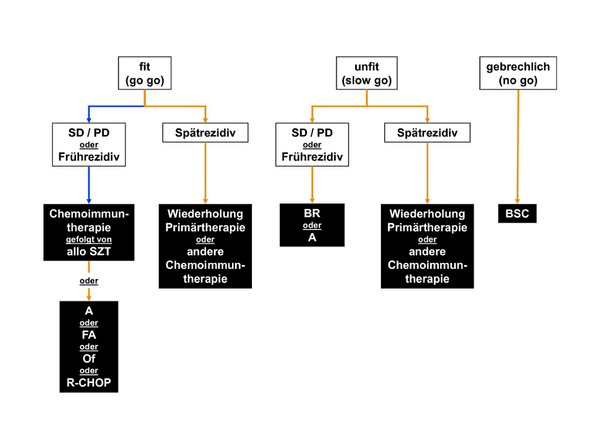
 palliativer Therapieansatz;
palliativer Therapieansatz; kurativer Therapieansatz;
kurativer Therapieansatz;
A - Alemtuzumab, allo SZT - allogene Stammzelltransplantation, B - Bendamustin, BSC - Best Supportive Care, C - Cyclophosphamid, d - dosisadaptiert, H - Doxorubicin, O - Vincristin, Of - Ofatumumab, P - Prednison, PD - Progress, R - Rituximab, SD - stabile Erkrankung;
5.3.1 Progress / Refraktarität / Frührezidiv
Patienten, die auf die derzeitigen Standardtherapien (FC, FCR, BR) refraktär sind oder nur eine kurze Remission (< 2 Jahre) erzielen, haben eine schlechte Prognose. Ihre mittlere Gesamtüberlebenszeit beträgt 1 - 2 Jahre, gerechnet ab dem Zeitpunkt der Salvagetherapie.
Zugelassen in dieser Situation ist der Pan-Lymphozyten Antikörper Alemtuzumab, sieheAnhang Chronische Lymphatische Leukämie Zulassungsstatus. Beim Einsatz von Alemtuzumab sind eine erweiterte antiinfektive Prophylaxe und ein engmaschiges infektiologisches Monitoring erforderlich. Bei positiver CMV Serologie muss mit CMV-Reaktivierungen gerechnet werden.
Der monoklonale anti-CD20 Antikörper Ofatumumab ist für Patienten zugelassen, die auf ein Fludarabin-haltiges Schema und Alemtuzumab refraktär waren (Deutschland, Österreich) und / oder für diese Therapien nicht geeignet sind (Schweiz).
Alternativ kann bei Patienten in gutem Allgemeinzustand und aggressivem Verlauf der CLL auch eine Chemoimmuntherapie wie bei Non-Hodgkin-Lymphomen durchgeführt werden, z. B. R-CHOP.
Desweiteren werden zurzeit mehrere neue Substanzen bei der refraktären / rezidivierten CLL evaluiert (u.a. Lenalidomid, Flavopiridol, ABT263, CAL101, PCI32765 etc.), wobei hier aufgrund der eingeschränkten Datenlage eine Therapie außerhalb von Studien nicht empfohlen werden kann.
5.3.2 Spätrezidiv
Trotz eingeschränkter Datenbasis erscheint es grundsätzlich gerechtfertigt, bei gutem Ansprechen und längerer Remissionsdauer von mindestens 1-2 Jahren (abhängig von der Intensität der Therapie) nach der Primärtherapie dasselbe Regime erneut zu verwenden.Grundsätzlich Grundsätzlich kann angenommen werden, dass bei Hinzunahme von Rituximab mit einer Steigerung der Wirksamkeit zu rechnen ist. Neben intensiven Fludarabin-haltigen Kombinationstherapien, wie z.B. der Kombinationstherapie FCR, stehen auch BR oder der Antikörper Alemtuzumab in der Rezidivtherapie zur Verfügung.
5.4 Therapie bei Autoimmunphänomenen
Autoimmunhämolytische Anämie (AIHA) und Immunthrombozytopenie (ITP) sind häufige Begleitphänomene der CLL.AIHA ist in der Regel Coombs-positiv. Kälteagglutinine mit Nachweis von IgM Antikörpern sind die Ausnahme. Coombs-negative hämolytische Anämien wurden nach vorangegangener Purinanaloga - Therapie beschrieben. Die Patienten sind auf die besonders hohe Gefährdung durch Krisen im Rahmen von Infekten hinzuweisen.Selten wird eine Pure Red Cell Aplasia (PRCA) beobachtet. Bei alleinigem Auftreten einer AIHA oder ITP ohne sonstige Symptome einer behandlungsbedürftigen CLL (s.o.) ist eine Therapie mit Kortikosteroiden indiziert. Therapieoptionen bei fehlendem Ansprechen auf Kortikosteroide sind z. B.RCD, R-COP oder R-CHOP.Die Monotherapie mit Purinanaloga ist bei aktiven Autoimmunphänomenen kontraindiziert.
5.5 Allogene Stammzelltransplantation
Für Patienten mit Therapie - refraktärer oder früh rezidivierter CLL (siehe Kapitel 5.3) stellt die allogene Stammzelltransplantation eine sinnvolle Option dar, sofern der Verlauf und der körperliche Zustand dies zulassen. Eine weitere Indikation für die allogene Stammzelltransplantation ist der Nachweis einer Deletion 17p bzw. TP53-Mutation bei therapiebedürftiger Erkrankung.
Indikation, Zeitpunkt und Durchführung einer Transplantation inklusive der Spendersuche sollten in enger Kooperation mit einem Transplantationszentrum vor Einleitung einer Salvage- bzw. Erstlinientherapie abgeklärt werden. Ein wichtiger prognostischer Faktor für das Erreichen einer langfristigen Krankheitskontrolle ist das Vorhandensein einer Remission zum Zeitpunkt der allogenen Transplantation. Die Transplantation sollte, sofern möglich, innerhalb klinischer Studien erfolgen.
5.6 Autologe Stammzelltransplantation
Die Hochdosistherapie mitautologerTransplantation führt zu einer Erhöhung der Remissionsraten im Vergleich zu einer Standardchemotherapie, nicht aber zu einer Verbesserung der Überlebensraten, sieheStudienergebnisse Chronische Lymphatische Leukämie. Vergleiche mit einer Immunchemotherapie fehlen. Die Hochdosistherapie mit autologer Stammzelltransplantation kann außerhalb von Studien derzeit nicht empfohlen werden.
5.7 Supportive Therapie und Therapie von Komplikationen
CLL Patienten zeigen häufig im Krankheitsverlauf Infektionskomplikationen, die durch die Abnahme der Immunglobulin-Konzentrationen und weitere Mechanismen eines erworbenen Immundefizits verstärkt werden. Besonders sorgfältige Überwachung intensiver allgemein-internistischer Behandlungen z.B. chronischer oder rezidivierender Bronchitiden ist angezeigt. Die prophylaktische Substitution mit Immunglobulinen reduziert das Risiko für schwere Infektionen, hat aber keinen signifikanten Einfluss auf die Mortalität [11]. Sie kann bei Patienten mit Hypogammaglobulinämie und gleichzeitig erhöhter Infektfrequenz durchgeführt werden.
Altersentsprechende Impfungen (z.B. gegen Influenza u. Pneumokokken) werden empfohlen, obwohl die Bildung spezifischer Antikörper vermindert sein kann. Reiseimpfungen sollten nur nach Rücksprache mit dem betreuenden Facharzt erfolgen, da u.a. Lebendimpfstoffe den Patienten gefährden könnten.
6 Verlaufskontrolle
Die Nachsorge asymptomatischer Patienten sollte eine Blutbilduntersuchung in einem Zeitabstand von ca. 3-6 Monaten neben einer klinischen Untersuchung von Lymphknoten, Leber und Milz einschließen. Dabei sollte auf das Auftreten von Autoimmun-Zytopenien (AIHA, ITP) und Infektionen geachtet werden. Des Weiteren sollten schnelle Lymphknotenvergrößerungen, B-Symptome und/oder eine Erhöhung der LDH Anlass geben, neben einem Rezidiv der CLL auch eine Transformation in ein hochmalignes Lymphom (Richter Syndrom) auszuschließen.
7 Literatur
Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 48:198-204, 1981. PMID: 7237385
Döhner H, Stilgenbauer S, Benner A, et al.Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 343:1910-1916, 2000. PMID: 11136261
Dores GM, Anderson WF, Curtis RE, et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br J Haematol 139:809-819, 2007. DOI: 10.1111/j.1365-2141.2007.06856.x
Dreger P, Döhner H, Ritgen M et al: Allogeneic stem transplantation provides durable disease control in patients with chronic lymphocytic leukemia: long-term clinical and MRD results of the German CLL Study Group CLL3X trial. Blood 116:2438-2447, 2010. DOI: 10.1182/blood-2010-03-275420
Eichhorst BF, Busch R, Stilgenbauer S, et al.First-line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia.l Blood 114:3382-91, 2009. DOI: 10.1182/blood-2009-02-206185
Gribben JG, O`Brien S: Update on therapy of chronic lymphocytic leukemia. J Clin Oncol 29:544-550, 2011. DOI: 10.1200/JCO.2010.32.3865
Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 111:5446-5456, 2008. DOI: 10.1182/blood-2007-06-093906
Hallek M, Fingerle-Rowson G, Fink A-M, et al. First-Line Treatment with Fludarabine (F), cyclophosphamide (C), and Rituximab (R) (FCR) Improves Overall Survival (OS) in Previously Untreated Patients (pts) with Advanced Chronic Lymphocytic Leukemia (CLL): Results of a Randomized Phase III Trial On Behalf of An International Group of Investigators and the German CLL Study Group. Lancet 376:1164-1174, 2010. DOI: 10.1016/S0140-6736(10)61381-5
Hodgson K, Ferrer G, Pereira A et al.: Autoimmune cytopenia in chronic lymphocytic leukemia: diagnosis and treatment.Brit J Haematol 154:14-22, 2011. DOI: 10.1111/j.1365-2141.2011.08707.x
Knauf WU, Lissichkov, Aldaoud A, et al.Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 27:4378-4384, 2009. DOI: 10.1200/JCO.2008.20.8389
Raanani P, Gafter-Gvili A, Paul M et al.: Immunoglobulin prophylaxis in hematologic malignancies and hematopoietic stem cell transplantation. Cochrane Database Syst Rev CD006501, 2008. DOI: 10.1002/14651858.CD006501.pub2
Rai KR, Sawitsky A, Cronkite EP, et al. Clinical staging of chronic lymphocytic leukemia. Blood 46:219-234, 1975. PMID: 1139039
Rawstron AC, Bennett FL, O’Connor SJ, et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia (CLL). N Engl J Med 359:575-583, 2008. PMID: 18687638
Schetelig J, van Biezen A, Brand R, et al: Allogeneic hematopoietic stem-cell transplantation for chronic lymphocytic leukemia with 17p deletion: a retrospective European Group for Blood and Marrow Transplantation analysis. J Clin Oncol 26:5094-5100, 2008. PMID: 1139039
Stilgenbauer S, Zenz T, Winkler D, et al: Subcutaneous alemtuzumab in fludarabine-refractory chronic lymphocytic leukemia: clinical results and prognostic marker analyses from the CLL2H study of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 27:3994-4001, 2009. DOI: 10.1200/JCO.2008.21.1128
Zenz T, Mertens D, Küppers R, Döhner H, Stilgenbauer S. From pathogenesis to treatment of chronic lymphocytic leukaemia.Nat Rev Cancer 10:37-50, 2010. DOI: 10.1038/nrc2764
8 Aktive Studien
9 Medikamentöse Tumortherapie - Protokolle
Chronische Lymphatische Leukämie Medikamentöse Tumortherapie
10 Studienergebnisse
11 Zulassungsstatus
Chronische Lymphatische Leukämie Zulassungsstatus von Medikamenten
12 Links
Kompetenznetzwerk Maligne Lymphome:
http://www.lymphome.de
Deutsche Leukämie - und Lymphom - Hilfe e. V.:
www.leukaemie-hilfe.de
Deutsche CLL Studiengruppe:
www.dcllsg.de
13 Anschriften der Verfasser
Hämatologie, Onkologie, Immunologie
Abteilung Innere Medizin V
Departement Medizin
Luzerner Kantonsspital
Universitätsklinik f. Innere Medizin III
Onkologisches Zentrum
MK1-IST (66c)
Medizinische Klinik I
Klinik f. Innere Medizin V
Klinik für Innere Medizin III
14 Offenlegung potentieller Interessenkonflikte
Download
Reference:
Quellenangabe:
Onkopedia-Leitlinien werden kontinuierlich an den Stand des Wissens angepasst. Die jeweils gültige Version, AGB und Nutzungsbedingungen finden Sie unter www.onkopedia.com.
Für die kommerzielle Nutzung wenden Sie sich bitte an onkopedia@dgho.de.
Onkopedia guidelines are continuously adapted to the state of knowledge. The currently valid version, terms of use and general terms and conditions can be found at onkopedia-guidelines.info.
For commercial use, please contact onkopedia@dgho.de.




