Prostatakarzinom
Erstellung der Leitlinie
Stand: März 2012
1 Definition und Basisinformation
Prostatakrebs ist der mit Abstand häufigste Krebs des Mannes [1]. Histologisch handelt es sich bei über 98 % um Adenokarzinome. Andere seltene Malignome sind neuroendokrine Tumore unterschiedlicher Differenzierung, Urothelkarzinome, Plattenepithelkarzinome, Lymphome u.a.. Thema dieser Leitlinie ist das Adenokarzinom der Prostata. Für eine ausführliche Darstellung verweisen wir auf die aktuelle Version der interdisziplinären S3 Leitlinie zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms [2].
1.1 Epidemiologie
Pro Jahr werden in Deutschland etwa 65.000 Neuerkrankungen diagnostiziert. Das Prostatakarzinom macht 26 % aller Krebserkrankungen bei Männern aus mit einem mittleren Erkrankungsalter von 69 Jahren. Die Inzidenz steigt seit 1980 kontinuierlich. Die altersstandardisierte Mortalität ist in diesem Zeitraum um 20 % gesunken [1].
1.2 Risikofaktoren
Es gibt nur relativ wenige, gesicherte Risikofaktoren für die Entstehung eines Prostatakarzinoms [3]. Eine positive Familienanamnese wird in Deutschland bei 16 - 19 % der Patienten erhoben [4]. Risikofaktoren sind in Tabelle 1 zusammengefasst.
Risikofaktor | Anmerkung |
zunehmendes Alter | |
ethnischer Hintergrund | Afroamerikaner |
positive Familienanamnese |
|
hereditäre Syndrome | BRCA Träger |
chronische Prostatitis | sexuell übertragbare Erkrankungen und Prostatitis (RR 1,6) |
1RR - Relatives Risiko;
Männer mit Klinefelter Syndrom haben ein signifikant niedrigeres Risiko für ein Prostatakarzinom, siehe Leitlinie Klinefelter Syndrom und Krebs . Ob sich diese Situation durch eine frühzeitige Testosteronsubstitution ändert, ist nicht geklärt.
2 Vorbeugung und Früherkennung
2.1 Vorbeugung
2.1.1 Lebensstil und Ernährung
Es gibt keine ausreichend gesicherten Daten zur Prävention des Prostatakarzinoms durch Änderungen des Lebensstils oder durch bestimmte Formen und Bestandteile der Ernährung [5]. Eine prospektiv randomisierte Studie zu Selen und Vitamin E zeigte keinen positiven Effekt, siehe Studienergebnisse Prostatakarzinom .Die exzessive Aufnahme hochdosierter Vitaminpräparate kann das Risiko für aggressive Formen des Prostatakarzinoms erhöhen.
2.1.2 Medikamente
Die 5-alpha -Reduktase Inhibitoren Finasterid und Dutasterid vermindern das Risiko für die Diagnose eines Prostatakarzinoms um 20 - 25 %, siehe Studienergebnisse Prostatakarzinom . Gleichzeitig steigt der Anteil von Karzinomen mit hohem Gleason Score [6]. Ein signifikanter Einfluss auf die krebsspezifische oder die Gesamt-Überlebenszeit ist durch die medikamentöse Prävention nicht nachgewiesen. Hauptnebenwirkungen sind erektile Dysfunktion, Nachlassen der Libido und Gynäkomastie.
2.2 Früherkennung bei asymptomatischen Personen (Screening)
Der lange zeitliche Verlauf zwischen dem ersten Nachweis histologischer Veränderungen in der Prostata und dem Auftreten klinischer Symptome bietet die Chance zur Früherkennung. Zu den Leistungen der gesetzlichen Krankenkassen im Rahmen der Krebs - Früherkennung für Männer gehört nur die jährliche, digitale rektale Untersuchung (DRU) ab dem 45. Lebensjahr.
Die aktuelle S3-Leitlinie empfiehlt, alleMänner, die mindestens 40 Jahre alt sind und eine mutmaßliche Lebenserwartung von mehr als 10 Jahren haben, über die Möglichkeit einer Früherkennung zu informieren und über die Vor- und Nachteile aufzuklären [2].
2.2.1 Digitale rektale Untersuchung (DRU)
Die digitale rektale Untersuchung hat eine hohe Spezifität zur Detektion eines Prostatakarzinoms, aber eine geringe Sensitivität[2,7]. Daten über einen positiven Einfluss der regelmäßigen DRU auf die Prostatakrebs-spezifische Überlebenszeit gibt es nicht.
2.2.2 PSA
Die quantitative Bestimmung des Prostata - spezifischen Antigens (PSA) ist ein geeigneter Parameter zur Verlaufsbeobachtung von Patienten mit Prostatakarzinom. Seit mehr als 20 Jahren wird PSA auch im Screening asymptomatischer Männer eingesetzt. Sensitivität und Spezifität dieses Parameters sind abhängig von der Definition des Schwellenwertes. Bei einer Grenze von 4 ng/ml ist die Sensitivität zur Detektion eines Prostatakarzinoms hoch. Die Spezifität sinkt mit zunehmendem Alter.
In prospektiv randomisierten Studien wurde der Wert des PSA Screening gegen Beobachtung getestet, siehe Studienergebnisse Prostatakarzinom . Die Ergebnisse lassen sich folgendermaßen zusammenfassen [8]:
Die Rate von Prostatakarzinomen ist signifikant höher in der Screening- verglichen mit der Beobachtungsgruppe.
Die Ergebnisse in Bezug auf die Prostatakrebs-spezifische Mortalität sind uneinheitlich.
Das Screening hat keinen Einfluss auf die Gesamtüberlebenszeit.
Nachteile des PSA-Screening sind eine hohe Rate falsch-positiver Ergebnisse und Belastungen, die mit der Abklärung erhöhter PSA-Werte assoziiert sind.
Die Testverfahren zur PSA Bestimmung sind nicht standardisiert. Ergebnisse sind abhängig von dem jeweiligen Testverfahren. Die Berechnung des Quotienten aus freiem PSA und Gesamt PSA kann bei PSA-Werten zwischen 4 und 10 ng/ml zur Steigerung der Spezifität angewandt werden, ist aber nicht prospektiv validiert.
Der Einsatz weiterer immunologischer und molekularer Methoden zur Untersuchung von Serum oder Urin wird derzeit außerhalb von Studien nicht empfohlen. Dies gilt auch für bildgebende Screening-Verfahren.
3 Klinisches Bild
Frühsymptome fehlen. Bei lokalisierter Erkrankung unterscheiden sich die klinischen Beschwerden oft nicht von denen einer benignen Prostatahyperplasie. Krankheitszeichen sind:
Lokale Symptome (absteigende Häufigkeit)
Miktionsbeschwerden
verlängerte Miktion mit schwachem Harnstrahl
Inkontinenz
Pollakisurie
Nykturie
Dysurie
Algurie
Erektionsstörungen
perineales Druckgefühl
Hämaturie
Hämatospermie
Allgemeinsymptome bei fortgeschrittener Erkrankung
ungewollte Gewichtsabnahme
Leistungsknick
Anämie
paraneoplastische Syndrome, z. B. Thromboseneigung, siehe auch Leitlinie TE bei Tumorpatienten
Weitere häufigere Symptome aufgrund von Metastasen sind Knochenschmerzen oder pathologische Frakturen bei Skelettmetastasen. Seltene Komplikationen sind Lymphödem bei ausgeprägten iliakalen Lymphknotenmetastasen, neurologische Symptome bei cerebraler Metastasierung oder bei spinaler Kompression durch Wirbelkörpermetastasen, Husten und Dyspnoe bei pulmonaler und / oder pleuraler Metastasierung, Ikterus und Leberinsuffizienz bei fortgeschrittener Lebermetastasierung.
4 Diagnose
4.1 Primärdiagnostik
Der erste Schritt ist die Bestätigung der klinischen oder laborchemischen Verdachtsdiagnose [2,7], s. Tabelle 2. Eine weiterführende Diagnostik ist nicht sinnvoll, wenn das Ergebnis aufgrund der persönlichen Entscheidung des Patienten oder aufgrund limitierender Komorbidität nicht therapierelevant ist.
Untersuchung | Anmerkungen |
digitale rektale Untersuchung (DRU) | |
PSA Bestimmung quantitativ | Berücksichtigung von Störfaktoren wie Harnverhalt, akute Prostatitis, vorherige Manipulation an der Prostata (z. B. DRU, Katheterismus, Rektoskopie / Koloskopie) |
Stanzbiopsie | wenn folgende Bedingungen erfüllt sind:
|
Die Stanzbiopsie soll unter transrektal-sonographischer Kontrolle und unter Antibiotikaschutz erfolgen. In der Regel sollen 10 bis 12 Gewebezylinder entnommen werden. Grundlage der weiteren Behandlungsempfehlung an den Patienten ist die qualitätsgesicherte, pathohistologische Aufarbeitung und Befundung [2].
4.2 Klassifikation und weitere Diagnostik (Staging)
Die Klassifikation der Ausdehnung des Primärtumors und der Metastasierung erfolgt auf der Basis der TNM Kriterien (Tabelle 3), die Klassifikation prognostisch relevanter histologischer Parameter nach dem Gleason Score [9].
klinisches Stadium | UICC | Primärtumor | Lymphknoten | Fernmetastasen | Grading |
lokal begrenzt | I | T1a | N0 | M0 | G1 |
lokal fortgeschritten | III | T3a | N0 | M0 | jedes G |
metastasiert1 | IV | jedes T | N1 | M0 | jedes G |
1Dieses Stadium wird auch als fortgeschritten (advanced) bezeichnet.
Der Gleason-Score ist ein histologisches Maß für die Malignität des Tumorgewebes. Er unterscheidet 5 Differenzierungsgrade. Hochdifferenziertes Gewebe wird mit einer 1, entdifferenziertes Gewebe mit einer 5 bewertet. Der Gleason-Score besteht auszwei Zahlen:
1. Zahl häufigster Differenzierungsgrad in den Stanzbiopsien
2. Zahl zweithäufigster Differenzierungsgrad in den Stanzbiopsien
Für das lokal begrenzte Karzinom wird auf der Basis von Gleason Score, T Kategorie und PSA Wert eine zusätzliche Einteilung in drei Risikostufen vorgenommen, siehe Abbildung 1. Diese Einteilung ist auch die Basis der Empfehlungen für weiterführende bildgebende Diagnostik.
1Die Zuordnung des Stadiums cT2c ist uneinheitlich. Es wird entweder der mittleren oder der hohen Risikogruppe zugeordnet [EAU, ESMO]
Die Positronenemissionstomographie (PET-CT) gehört nicht zum Standard in der Primärdiagnostik des Prostatakarzinoms.
4.3 Geriatrisches Assessment
Zur objektiven Erfassung des Allgemeinzustands wird die Verwendung von Instrumenten des Geriatrischen Assessment empfohlen, siehe Abbildung 2 und Wissensdatenbank Geriatrisches Assessment [10]. Besonders geeignet sind Tests zur Objektivierung von Selbstständigkeit, Mobilität und Komorbidität. Die Indikation zur Durchführung weiterer Tests orientiert sich am klinischen Eindruck und an der geplanten Behandlung.
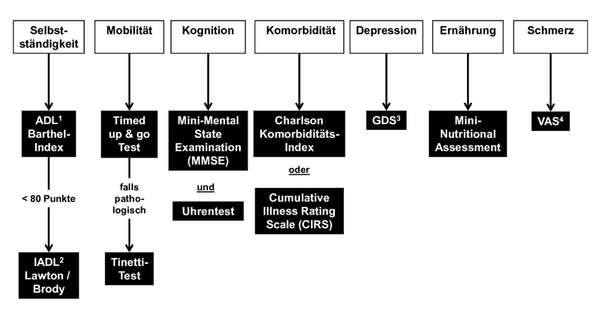
1ADL - Activity of Daily Living;2IADL - Instrumental Activities of Daily Living;3GDS - Geriatrische Depressionsskala;4VAS - Visuelle Analogskala;
5 Therapie
Die Behandlung erfolgt stadienabhängig. Aktuell gibt es in allen Stadien des Prostatakarzinoms mehrere Therapiemöglichkeiten [2,7]. Aufgabe interdisziplinärer Tumorkonferenzen ist die kritische Abwägung der differenzialtherapeutischen Optionen als Basis der ärztlichen Empfehlung. Die umfassende Information des Patienten ist Voraussetzung für seine autonome Entscheidung. Ein Algorithmus für die Primärtherapie ist in Abbildung 3 dargestellt. Wenn immer möglich, sollen Patienten im Rahmen klinischer Studien behandelt werden.
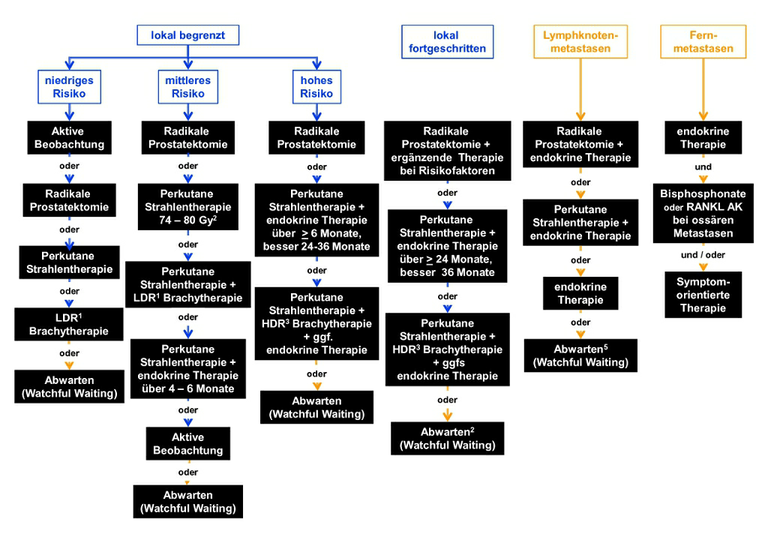
 kurative Therapie;
kurative Therapie; palliative Therapie;1LDR - Low Dose Rate;2Gy - Gray;3HDR - High Dose Rate;4RANKL AK - Antikörper gegen den RANK Liganden;5bei asymptomatischen Patienten;
palliative Therapie;1LDR - Low Dose Rate;2Gy - Gray;3HDR - High Dose Rate;4RANKL AK - Antikörper gegen den RANK Liganden;5bei asymptomatischen Patienten;
5.1 Stadienabhängige Therapie
5.1.1 Lokal begrenzt - niedriges Risiko
Bei diesen Patienten besteht eine hohe Heilungschance durch Operation oder Bestrahlung, aber auch die Gefahr einer Übertherapie. Optionen sind:
Perkutane Bestrahlung der Prostata mit 74 - 80 Gy
LDR - Brachytherapie mit125Iod in einer Dosis von 145 Gy
Abwarten - palliativer Therapieansatz
Beobachtungsstudien zeigen für alle Therapieoptionen eine Prostatakrebsspezifische Überlebensrate zwischen 90 und 97 % nach 10 Jahren.
5.1.2 Lokal begrenzt - mittleres Risiko
Die Gruppe der Patienten mit intermediärem Risiko ist heterogen. Die Heilungschancen durch Operation oder Bestrahlung sind hoch, es besteht aber auch die Gefahr einer Übertherapie. Optionen sind:
Perkutane Bestrahlung der Prostata
mit 74 - 80 Gyoder
in Kombination mit LDR Brachytherapieoder
in Kombination mit endokriner Therapie über 4 - 6 Monate
Aktive Beobachtung (Active Surveillance) bei Anwendung erweiterter Kriterien
Abwarten - palliativer Therapieansatz
5.1.3 Lokal begrenzt - hohes Risiko
Aufgrund des hohen Progressionsrisikos wird die unmittelbare Einleitung einer kurativen Therapie empfohlen. Alternative bei Kontraindikationen ist ein palliativer, symptom-orientierter Ansatz. Optionen sind:
Perkutane Bestrahlung der Prostata
in Kombination mit endokriner Therapie über 6 Monate, besser 24 - 36 Monate,oder
in Kombination mit HDR Brachytherapie, ggf. mit endokriner Therapie
Abwarten - palliativer Therapieansatz
5.1.4 Lokal fortgeschritten
Bei Patienten mit lokal fortgeschrittenem Prostatakarzinom werden lokale Verfahren und ggf. endokrine Therapie kombiniert. Optionen sind:
plus postoperative Bestrahlung bei positiven Resektionsrändern
Salvage Bestrahlung bei postoperativem PSA Wert > Nullbereich
plus ggf. endokrine Therapie
Perkutane Bestrahlung der Prostata
in Kombination mit endokriner Therapie über 3 Jahreoder
in Kombination mit HDR Brachytherapie und ggf. endokrine Therapie
Abwarten bei asymptomatischen Patienten
5.1.5 Lymphknotenmetastasen
Bei der großen Mehrzahl der Patienten mit positivem Lymphknotenbefund ist die Therapie palliativ. In Abhängigkeit von den individuellen Risikofaktoren und dem Therapieansprechen kann die Prostatakrebs-spezifische Überlebensrate nach 10 Jahren aber bei bis zu 80 % liegen. Optionen sind:
Radikale Prostatektomie plus endokrine Therapie über mindestens 2 Jahre
Perkutane Bestrahlung plus begleitende endokrine Therapie über 3 Jahre
Endokrine Therapie ohne lokale Primärtherapie
Abwarten bei asymptomatischen Patienten
5.1.6 Fernmetastasen - hormonsensitiv
Die Therapie ist palliativ. An erster Stelle steht die systemische Therapie, ggf. ergänzt durch lokale Therapiemaßnahmen. Optionen sind:
Bisphosphonate oder RANKL Antikörper bei ossären Metastasen
Abwarten bei asymptomatischen Patienten
5.1.7 Kastrationsresistentes Prostatakarzinom
Die Therapie ist palliativ. Sie richtet sich nach dem Allgemeinzustand, der Vorbehandlung, der Symptomatik, spezifischer Komorbidität und der Patientenpräferenz, siehe Abbildung 4.
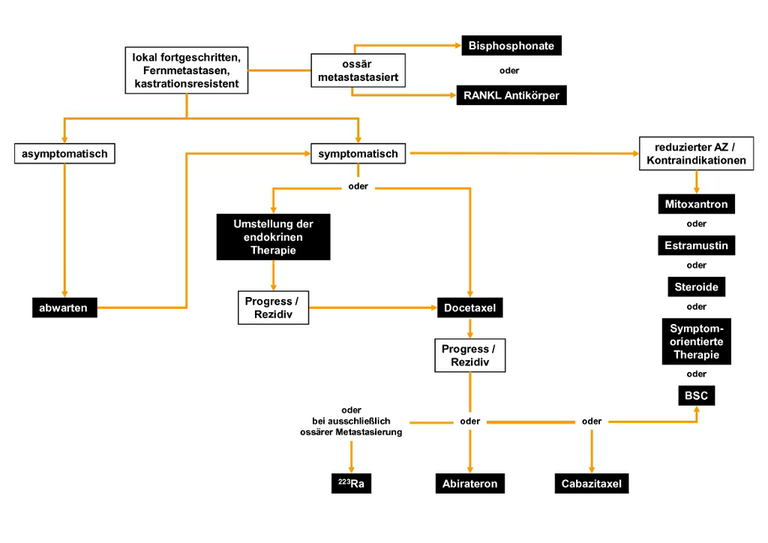
1symptomatisch: in die Studien zur Wirksamkeit von Docetaxel wurden auch Patienten mit einem PSA Anstieg in drei konsekutiven Messungen aufgenommen.
Optionen sind
Bisphosphonate oder RANKL Antikörper bei ossären Metastasen
Abwarten bei asymptomatischen Patienten
5.1.8 Rezidiv
Die große Mehrzahl von Rezidiven nach kurativer Therapie wird durch einen Anstieg des PSA Wertes diagnostiziert. Salvage - Prostatektomie und - Bestrahlung haben einen kurativen Anspruch. Entscheidungskriterien und Therapieoptionen sind abhängig von der Art der Primärtherapie. Zu unterscheiden sind
Biochemischer Progress / Lokalrezidiv nach Radikaler Prostatektomie
Das Rezidiv ist definiert als ein PSA Wert > 0,2 ng / ml in mindestens zwei Messungen. Optionen sind
Bestrahlung der Prostataloge
Abwarten bei
PSA Verdopplungszeit > 10 Monate
Intervall zwischen Operation und Rezidiv > 2 Jahre
primärer Gleason Score < 8
Lokales Rezidiv nach Bestrahlung
Das Rezidiv ist definiert als ein PSA Wert > 2 ng / ml über dem postradiotherapeutischen Nadir in mindestens zwei Messungen. Optionen sind
Prostatektomie
Endokrine Therapie
Abwarten: Kriterien können sich am Lokalrezidiv nach Radikaler Prostatektomie orientieren
Metastasen
Die Therapieoptionen entsprechen denen der Primärtherapie bei Patienten mit Lymphknoten- bzw. Fernmetastasen.
5.2 Therapieoptionen
5.2.1 Aktive Beobachtung - Active Surveillance
Das Konzept wurde entwickelt, um Übertherapie bei Niedrig-Risiko-Patienten zu vermeiden - ohne Aufgabe des kurativen Anspruchs. Die Selektionskriterien wurden aus der publizierten Studie mit der längsten Nachbeobachtungszeit übernommen [11], ergänzt durch quantitative histologische Parameter, siehe Tabelle 4.
| Eingangskriterien- | Verlaufskontrollen | Interventionskriterien |
PSA | <10 ng / ml | alle 3 Monate über 2 Jahre, | PSA DT2< 3 Jahre |
Gleason-Score | <6 | Biopsie nach 6 - 12 Monaten | > 6 |
cT Stadium | 1 - 2a | ||
Histologie | Tumor in<2 Stanzen | Tumor in > 2 Stanzen | |
Beschwerden | symptomatischer Progress |
1weiter gefasste Eingangskriterien;2PSA DT - PSA Verdopplungszeit (Doubling Time); *Referenz:[2, 11]
In anderen Studien werden etwas weiter gefasste Eingangskriterien (PSA<15, Gleason -Score 7, cT2) verwandt und weitere Parameter wie prognostische Scores, Alter, Komorbidität und Lebensqualität mitbewertet [7].
5.2.2 Operation
Die Operation wird bei Patienten mit lokal begrenztem Prostatakarzinom in kurativer Absicht durchgeführt. Standard ist die radikale Prostatektomie. Onkologisches Ziel ist die vollständige Entfernung der Prostata mit tumorfreien Resektionsrändern. Die perioperative Mortalität liegt unter 2 % [7]. Belastende Langzeitnebenwirkungen sind vor allem obstruktive Miktionsbeschwerden, Harninkontinenz und erektile Dysfunktion.
5.2.2.1 Radikale Prostatekomie
Operationsmethoden bzw. -zugänge sind:
retropubisch
perineal
laparoskopisch (intra- oder extraperitoneal)
Roboter-assistiert (intra- oder extraperitoneal)
Getrennte Beobachtungsstudien zu den einzelnen Operationsverfahren zeigen vergleichbar gute onkologische Langzeitergebnisse. Die Entscheidung für eine bestimmte Operationstechnik hängt vor allem von der Erfahrung des jeweiligen Zentrums, von Kontraindikationen und von den Präferenzen des Patienten ab.
Nerverhaltende Operationstechniken können das Risiko der erektilen Dysfunktion vermindern. Im Einzelfall ist der Einsatz ein- oder beidseitiger, nerverhaltender Operationstechniken gegen das Risiko einer R1 Resektion abzuwägen [7].
5.2.2.2 Lymphadenektomie
Die Lymphadenektomie erlaubt eine präzisere Beurteilung des Krankheitsstadiums durch die pathohistologische Untersuchung der entnommenen Lymphknoten. Die Prognose der Patienten wird durch die Lymphadenektomie nicht verbessert.
Wird eine Lymphadenektomie durchgeführt, sollten mindestens 10 Lymphknoten entfernt werden. Je ausgedehnter die Lymphadenektomie durchgeführt wird, umso höher ist die Rate an positiven Befunden. Bei Niedrigrisiko - Patienten wird eine Lymphadenektomie nicht empfohlen. Bei Patienten mit höherem Risiko ist der potenzielle Erkenntnisgewinn durch gegen die postoperativen Komplikationen abzuwägen i. e. Lymphozelen, venöse Thrombembolien, Lymphödem [2].
5.2.2.3 Adjuvante / ergänzende Therapie nach radikaler Prostatektomie
Nach erfolgreicher radikaler Prostatektomie liegt der postoperative PSA Wert im Nullbereich. Falls dies nicht erreicht wird, ist eine Salvage Bestrahlung und ggf. eine ergänzende endokrine Therapie indiziert. Bei positiven Schnitträndern in der pathohistologischen Begutachtung ist eine ergänzende Bestrahlung indiziert.
Eine ergänzende endokrine Therapie, ggf. mit perkutaner Strahlentherapie, kann bei positivem Lymphknotenbefund eingeleitet werden. Alternatives Konzept ist die Einleitung der endokrinen Therapie bei Anstieg des PSA Wertes.
Eine adjuvante Chemotherapie ist beim Prostatakarzinom nicht indiziert.
5.2.3 Bestrahlung
Die Bestrahlung wird in kurativer Absicht durchgeführt. Sie ist eine Alternative zur radikalen Prostatektomie mit vergleichbaren onkologischen Ergebnissen [12]. Die Bestrahlung kann als perkutane Strahlentherapie, als LDR-Brachytherapie oder in Kombination von perkutaner Strahlentherapie mit HDR-Brachytherapie durchgeführt werden.
5.2.3.1 Perkutane Strahlentherapie (Teletherapie) der Prostata
Die Ergebnisse der perkutanen Strahlentherapie sind dosisabhängig, siehe Studienergebnisse Prostatakarzinom . Dosierungen von 74 - 80 Gy führen zu einer signifikanten Reduktion der biochemischen Progressionsraten im Vergleich zu Dosierungen von 64 - 70 Gy, allerdings ohne Einfluss auf die Gesamtüberlebenszeit. Aktuell wird eine Dosis von>72 Gy [2] bzw.>74 Gy und < 80 Gy [7] empfohlen. Die perkutane Strahlentherapie der Prostata wird auf der Basis dreidimensionaler Bestrahlungsplanung durchgeführt [2]. Hauptnebenwirkungen entstehen durch die Strahlenbelastung des Rektums (veränderter Stuhlgang, rektale Blutung) sowie von Blase und Urethra (Zystitis, Dysurie, Funktionsstörungen). Weitere Nebenwirkungen sind erektile Dysfunktion und ein erhöhtes Risiko für Zweitneoplasien.
Intensitätsmodulierte Bestrahlung (IMRT) kann das Nebenwirkungsrisiko reduzieren. Der Gewinn der IMRT ist beim Prostatakarzinom nicht durch randomisierte Studien belegt.
5.2.3.2 Low Dose Rate Brachytherapie (LDR - Brachytherapie)
Low-Dose-Rate- Brachytherapie (LDR-Brachytherapie) wird in Deutschland mit125Iod durchgeführt. Die Implantate werden perineal dauerhaft in einer Dosis von 145 Gy appliziert. Hauptnebenwirkungen der Brachytherapie sind Funktionsstörungen des Harntraktes und erektile Dysfunktion. Die Strahlenbelastung des Rektums ist geringer als bei perkutaner Bestrahlung, die Belastung der Harnröhre höher.
Besonderheit der LDR Brachytherapie ist ein transienter Anstieg des PSA Wertes, der sogenannte PSA Bounce. Er tritt bei bis zu 40 % der Patienten auf und hat keine klinische Relevanz.
5.2.3.3 High Dose Rate Brachytherapie (HDR - Brachytherapie)
Die High Dose Rate Brachytherapie (HDR - Brachytherapie) ermöglicht eine dosisintensivierte, temporäre Bestrahlung der Prostata mittels transrektaler Sonde in Afterloading Technik. In Kombination mit perkutaner Bestrahlung ist sie eine Option zur Dosiseskalation für Patienten mit lokal begrenztem Prostatakarzinom mittleren und hohen Risikos sowie bei lokal fortgeschrittenem Prostatakarzinom, siehe Studienergebnisse Prostatakarzinom . Ergebnisse randomisierter Studien zum Vergleich einer perkutanen Strahlentherapie mit Dosierungen von 74 - 80 Gy versus der Kombination von perkutaner Strahlentherapie plus HDR Brachytherapie liegen nicht vor.
5.2.3.4 Perkutane Strahlentherapie des Beckens (Lymphabflusswege)
Die Daten zur Bestrahlung der pelvinen Lymphabflussgebiete sind widersprüchlich und nicht abschließend beurteilbar. In konventioneller Bestrahlungstechnik ist die Nebenwirkungsrate erhöht, mit intensitätsmodulierter Bestrahlung signifikant niedriger.
5.2.3.5 Perkutane Strahlentherapie plus endokrine Therapie
Die Kombination von perkutaner Strahlentherapie (64 - 70 Gy) und endokriner Therapie führt bei Patienten mit lokal begrenztem Prostatakarzinom des mittleren und hohen Risikos sowie bei lokal fortgeschrittenem Prostatakarzinom zu einer signifikanten Verbesserung der Progressionsrate und kann die Überlebenszeit verlängern, siehe Studienergebnisse Prostatakarzinom . Der positive Einfluss der endokrinen Therapie ist unabhängig davon, ob sie neoadjuvant, parallel zur Strahlentherapie und / oder adjuvant durchgeführt wurde.
Für Patienten mit intermediärem Risiko wird eine Dauer der endokrinen Therapie von 4 - 6 Monaten, für Patienten mit hohem Risiko von 24 - 30 Monaten empfohlen.
Nicht geklärt ist, ob eine zusätzliche endokrine Therapie die Prognose der Patienten auch bei den heute empfohlenen, höheren Bestrahlungsdosen (74 - 80 Gy) noch weiter verbessert.
5.2.4 Abwarten - Watchful Waiting
In diesem Konzept werden Patienten erst bei symptomatischer Erkrankung behandelt. Der Therapieanspruch ist palliativ. Bisher wurden Ergebnisse von zwei prospektiv randomisierten Studien zum Vergleich von Watchful Waiting und kurativer Therapie publiziert, siehe Studienergebnisse Prostatakarzinom.In der Studie mit der längsten Nachbeobachtungszeit [13] zeigte sich ein signifikanter Überlebensvorteil für die radikale Prostatektomie, allerdings nur für Patienten < 65 Jahre.Da das chronologische Alter wegen der fehlenden Berücksichtigung der individuellen Komorbidität ein ungeeigneter Parameter ist, empfiehlt sich eine Orientierung an der Lebenserwartung der Patienten.
Anhaltspunkte für die Entscheidung zu einem abwartenden Verhalten sind:
niedriges oder mittleres Risiko
asymptomatische Patienten mit höherem Risiko
Lebenserwartung < 10 - 15 Jahre
Patientenpräferenz
5.2.5 Andere lokale Therapieverfahren
Verschiedene physikalische Methoden werden zur gezielten Therapie, vor allem mit Verfahren der minimal-invasiven Chirurgie, eingesetzt. Am weitesten verbreitet sind die Kryotherapie und der hochintensive fokussierte Ultraschall (HIFU). Kontrollierte vergleichende Studien mit Langzeitbeobachtung fehlen. Diese physikalischen Verfahren sind experimentell. Ihr Einsatz wird außerhalb klinischer Studien nicht empfohlen.
5.2.6 Endokrine Therapie
Prostatakarzinomzellen exprimieren Androgenrezeptoren. Die Bildung von Testosteron und seinen Derivaten, die Rezeptorbindung und die Expression von Androgenrezeptoren sind Ansatzpunkte für wirksame pharmakologische Therapie. Endokrine Therapie ist hoch effektiv bei Patienten mit Prostatakarzinom. Sie wird als Erstlinientherapie in der metastasierten und zunehmend auch in der adjuvanten Situation nach Bestrahlung in kurativer Intention eingesetzt [14].
5.2.6.1 Orchiektomie
In den Jahren 1940 und 1941 publizierten Niehans bzw. Huggins ihre Beobachtungen über die Hormonabhängigkeit des Prostatakarzinoms und den Effekt der Orchiektomie. Die chirurgische Kastration wurde zum Standard in der Therapie von Patienten mit fortgeschrittener Erkrankung.Als älteste Methode ist die bilaterale Orchiektomie etabliert. Sie eliminiert den Bildungsort von Testosteron. Die Methode ist kostengünstig. Spezifische Nachteile der Orchiektomie sind die psychische Belastung und die Irreversibilität der Androgensuppression.
5.2.6.2 GnRH Agonisten (Analoga)
GnRH Angonisten senken den Testosteronspiegel innerhalb von 3 - 4 Wochen auf Kastrationsniveau. Nach Absetzen der Medikamente ist der Effekt reversibel. Die Applikation erfolgt subkutan. Nebenwirkungen entsprechen denen anderer Formen der Androgensuppression, Die erste Applikation von GnRH Analoga induziert einen kurzfristigen Anstieg des Testosteronspiegels und einen PSA Anstieg mit dem Risiko einer initialen Verschlechterung der klinischen Symptomatik (Flare Phänomen). Durch die gleichzeitige Gabe von Antiandrogenen in den ersten beiden Therapiewochen kann dieser Effekt verhindert werden. Zu den GnRH Agonisten gehören Leuprorelin, Goserelin, Triptorelin, Buserelin und Histrelin. GnRH Agonisten sind Medikamente der ersten Wahl in der endokrinen Therapie.
5.2.6.3 GnRH Antagonisten (Blocker)
Antagonisten des Gonadotropin Releasing Hormons (GnRH) binden kompetitiv an den Rezeptor in der Hypophyse. Die Blockade der Freisetzung von LH (Luteinisierendes Hormon) und FSH (Follkel Stimulierendes Hormon) führt innerhalb von 1 - 3 Tagen zu einer Verminderung der Testosteronproduktion auf Kastrationsniveau. Zu dieser Substanzgruppe gehören Abarelix und Degarelix. Nebenwirkungen entsprechen denen anderer Formen der Androgensuppression. Bei Abarelix besteht das Risiko schwerwiegender systemischer allergischer Reaktionen. Ergebnisse der Langzeitbeobachtungen randomisierter Studien stehen aus.
5.2.6.4 Antiandrogene: Bicalutamid / Flutamid
Die nicht-steroidalen Antiandrogene Bicalutamid und Flutamid sind kompetitive Inhibitoren an den Androgenrezeptoren. Sie sind effektiv in der Therapie des fortgeschrittenen und des metastasierten Prostatakarzinoms. Im Vergleich mit LHRH Agonisten waren die Langzeitergebnisse bezüglich des progressionsfreien und der Gesamtüberlebens uneinheitlich mit einer Tendenz zu ungünstigeren Ergebnissen bei den nicht-steroidalen Androgenen. Vorteil dieser Substanzgruppe ist das etwas günstigere Nebenwirkungsspektrum mit geringerer Beeinträchtigung von Leistungsfähigkeit und sexuellem Interesse, verglichen mit LHRH Agonisten. Spezifische Nebenwirkung ist die Hepatotoxizität.
5.2.6.5 Inhibitoren von Cytochrom P450 c17 (CYP17)
Cytochrom P450 ist ein zentrales Enzym in der Testosteronsynthese. Unspezifische (Ketoconazol, Aminogluthetimid) und spezifische Inhibitoren (Abirateron) blockieren die physiologische Androgensynthese in Hoden und Nebennieren, aber auch die autonome Produktion in den Tumorzellen. Abirateron wurde zuerst bei Patienten mit kastrationsresistentem Prostatakarzinom im Progress unter oder nach palliativer Docetaxel-Chemotherapie getestet und führte zu einer signifikanten Verlängerung der Überlebenszeit, siehe Prostatakarzinom Studienergebnisse[15]. Spezifische Nebenwirkungen sind auf die mineralokortikoide Wirkung zurückzuführen, i. e. Ödeme, Hypertonie und Hypokaliämie.
5.2.6.6 Neue Androgenrezeptor (AR) - Antagonisten
Einer der pathophysiologischen Mechanismen des kastrationsrefraktären Prostatakarzinoms ist die Reaktivierung des Androgenrezeptors (AR) in den Tumorzellen trotz maximaler Androgensuppression. Hoch selektive und spezifische AR-Antagonisten bieten neue Therapieoptionen. Am weitesten in der klinischen Prüfung ist MDV3100. Eine große Phase III Studie wurde abgeschlossen, die Ergebnisse sind noch nicht publiziert, siehe Prostatakarzinom Studienergebnisse .
5.2.6.7 Cyproteronacetat
Cyproteronacetat ist ein steroidales Antiandrogen. Es blockt sowohl Androgenrezeptoren als auch die Freisetzung von GnRH. Cyproteron wird seit über 40 Jahren in der Therapie des metastasierten Prostatakarzinoms eingesetzt. Trotzdem gibt es nur wenige Daten zu Langzeitergebnissen. Im Vergleich mit LHRH Agonisten ist das progressionsfreie Überleben etwas kürzer, in der Kombination verhindert es das Flare Phänomen. Eine spezifische Nebenwirkung ist die Hepatotoxizität.
5.2.6.8 Maximale Androgenblockade
Die Kombination von Androgensuppression (Androgendeprivation) und Antiandrogenen wird als maximale Androgenblockade bezeichnet. In mehreren klinischen Studien wurde die maximale Androgenblockade mit der Androgensuppression (Orchiektomie oder LHRH Agonisten) bei Patienten mit lokal begrenztem und / oder lokal fortgeschrittenem Prostatakarzinom verglichen. Die Ergebnisse sind uneinheitlich, siehe Prostatakarzinom Studienergebnisse . In Metaanalysen zeigt sich ein leichter, aber statistisch nicht signifikanter Vorteil für die Kombinationstherapie. Sie ist mit einer höheren Nebenwirkungsrate assoziiert [16].
5.2.6.9 Intermittierende Therapie
Zu Reduktion der Nebenwirkungen einer langfristigen Androgensuppression wurde das Konzept der intermittierenden Therapie eingeführt und vor allem in Phase II Studien getestet. In einer aktuell publizierten Phase III Studie zeigten sich keine signifikanten Unterschiede in der Überlebenszeit zwischen der intermittierenden und der kontinuierlichen Therapie. Unter der intermittierenden Therapie hatten Patienten signifikant weniger Nebenwirkungen und eine signifikante höhere Lebensqualität, siehe Prostatakarzinom Studienergebnisse .
5.2.6.10 Antiandrogenentzug
Das Absetzen einer längerfristigen, antiandrogenen Therapie führt bei 15 - 30 % der Patienten zu einem Rückgang des PSA Wertes. Dieser Effekt kann über mehrere Monate anhalten, ist aber in der Regel nur von kurzer Dauer. Die klinischen Remissionsraten liegen unter 5 %, siehe Studienergebnisse Prostatakarzinom .
5.2.6.11 Umgang mit Nebenwirkungen der Androgensuppression
Die Nebenwirkungen der langfristigen Androgensuppression können erheblich sein und sind im Einzelfall gegen den onkologischen Gewinn dieser Therapie abzuwägen. Häufig sind Hitzewallungen (55 - 80 %), Gynäkomastie und Brustschmerz, Libidoverlust, erektile Dysfunktion, Verminderung der körperlichen Leistungsfähigkeit, Müdigkeit (Fatigue), metabolische Veränderungen mit Zunahme des Körperfetts und verminderter Glukosetoleranz, Osteoporose und Anämie. Patienten mit vorbestehenden kardialen Risikofaktoren (koronare Herzkrankheit, Z. n. Myokardinfarkt) haben eine erhöhte Mortalität unter antiandrogener Therapie. Empfehlungen zur spezifischen Prävention oder Therapie von belastenden Nebenwirkungen der Androgensuppression sind in Tabelle 5 zusammengefasst.
Nebenwirkung | Risikofaktoren | Therapieempfehlungen |
Anämie |
| Symptom-orientiert
|
erektile Dysfunktion |
| Phosphodiesterase 5 Inhibitoren
|
Gynäkomastie |
| |
Hitzewallungen |
| |
kardiovaskuläre Erkrankungen |
|
|
Libidoverlust | keine spezifische Therapie | |
metabolisches Syndrom |
|
|
Osteoporose |
|
|
1siehe Studienergebnisse Prostatakarzinom ;2Off-Label-Use
5.2.7 Chemotherapie
Chemotherapie ist indiziert beim hormonrefraktären Prostatakarzinom, siehe Abbildung 3. Mit unterschiedlichen Substanzen kann bei bis zu 50 % der Patienten ein Rückgang der PSA Werte um mindestens 50 % erreicht werden. Die objektiven Remissionsraten messbarer Tumormanifestationen liegen unter 20 %, siehe Prostatakarzinom Studienergebnisse .
In den randomisierten Studien wurde die Chemotherapie zusammen mit niedrigdosierten Steroiden (Prednisolon oder Prednison 5 mg 2 x / Tag oder 10 mg 1 x / Tag) gegeben. Sie gehören jetzt zum Standard in der Applikation dieser systemischen Therapie, sieheProstatakarzinom Systemtherapie.
5.2.7.1 Erstlinientherapie
Standard ist die dreiwöchentliche Gabe von dreiwöchentliche Docetaxel mit Prednison oder Prednison [17]. Indikation für die Einleitung der Therapie sind Tumor-assoziierte Symptome. Auch ein Anstieg des PSA-Wertes, bestätigt in zwei konsekutiven Messungen von mindestens 1 Woche, kann zum Beginn einer Chemotherapie führen. Erstes Ziel ist die Symptomlinderung. Weitere Ziele sind die Verlängerung des progressionsfreien Überlebens, die Verlängerung der Zeit bis zum Auftreten belastender Symptome und die Verlängerung der Überlebenszeit.
5.2.7.2 Zweitlinientherapie nach Docetaxel
Die Optionen in der Zweitlinie haben sich aktuell deutlich erweitert, so dass hier eine Differenzialtherapie möglich ist, siehe Abbildung 3. Zur Verfügung stehen
Abirateron
Cabazitaxel
223Ra
andere Chemotherapie: Docetaxel-Retherapie, Estramustin, Mitoxantron
Best Supportive Care einschl. Symptom-orientierter Therapie und Steroiden
Abirateron, Cabazitaxel und223Ra führen jeweils zu einer signifikanten Verlängerung der medianen Überlebenszeit um 2,4 bis 3,9 Monate. Ergebnisse direkter Vergleiche zwischen diesen drei Substanzen liegen nicht vor.
Für die Mehrzahl der Patienten bietet sich bei Docetaxel-Refraktärität oder im Rezidiv eine Sequenztherapie an. Diese beginnt mit Abirateron aufgrund des günstigeren Nebenwirkungsprofils. Bei Kontraindikationen oder relevanter Komorbidät (siehe Kapitel 5.2.6.5.), bei Abirateron-Refraktärität, im Rezidiv oder bei belastenden Nebenwirkungen wird die Behandlung mit Cabazitaxel empfohlen. Zu relevanter Komorbidität und Kontraindikationen bei Cabazitaxel siehe Kapitel 5.2.7.7. Bei ausschließlich ossärer Metastasierung und keiner Einschränkung der Knochenmarksreserve kann223Ra in der Sequenz vor Abirateron aber auch vor Cabazitaxel gegeben werden.
5.2.7.3 Therapiedauer
Die Dauer der Therapie ist abhängig vom Ansprechen und von der Verträglichkeit. In den Zulassungsstudien wurde die Therapie mit Docetaxel, Cabazitaxel oder mit Mitoxantron jeweils maximal über 10 Zyklen durchgeführt.
Patienten mit einem Rückgang des PSA-Wertes um mindestens 50 % unter einer Docetaxel-Therapie haben eine signifikant längere Überlebenszeit als Patienten mit keinem oder geringem Ansprechen (20,8 vs 11,4 Monate).
Für Patienten in reduziertem Allgemeinzustand, i. e. ECOG > 2, ist der Nutzen einer Chemotherapie nicht belegt.
5.2.7.4 Docetaxel
Docetaxel gehört zu den Taxanen. In einer randomisierten klinischen Studie zur Erstlinientherapie führte die dreiwöchentliche Gabe von Docetaxel zu einer Verlängerung der Überlebenszeit um 2,9 Monate im Vergleich zu Mitoxantron, siehe Prostatakarzinom Studienergebnisse . Die Remissionsraten lagen bei 12 %, der PSA Wert sank bei 45 % der Patienten. Die Lebensqualität wurde signifikant verbessert. Schwere Nebenwirkungen (Grad 3 / 4), die bei mehr als 20 % der Patienten in den Zulassungsstudien auftraten, waren: Alopezie (65 %), Fatigue (53 %), Übelkeit / Erbrechen (42 %), Neutropenie (32 %), Diarrhoe (32 %), sensorische Neuropathie (30 %), Onychodystrophie (30 %). Die Rate Therapie - assoziierter Todesfälle lag bei 0,3 %.
Eine Alternative ist die wöchentliche Applikation von Docetaxel. Sie ist gleich effektiv in der Senkung des PSA Wertes, führt aber nicht zu einer signifikanten Verlängerung der Überlebenszeit im Vergleich zu Mitoxantron. Die Nebenwirkungen sind ähnlich wie bei der dreiwöchentliche Gaben, das Risiko für eine Neutropenie Grad 3 / 4 ist aber sehr gering (2 %).
Analog zu den Zulassungsstudien wird in der Erstlinientherapie eine Behandlung bis zu 10 Zyklen empfohlen. Eine Fortsetzung der Chemotherapie bei Krankheitsprogress ist nicht sinnvoll. Bei einem Rezidiv nach Abschluss der Erstlinientherapie ist eine erneute Therapie mit Docetaxel möglich, falls keine limitierenden Nebenwirkungen aufgetreten sind. Sie kann bei bis zu 50 % der Patienten es zu einem erneuten Rückgang des PSA-Wertes führen. Das Intervall zwischen Erstlinien- und Retherapie soll mindestens 3 Monate betragen.
5.2.7.5 Mitoxantron
Mitoxantron gehört zur Gruppe der Anthrazykline und Anthracene. In einer randomisierten Studie in der Erstlinientherapie führte Mitoxantron zu einer signifikanten Verbesserung der Krankheitssymptome, zu einer Verlängerung des rezidivfreien Überlebens um 1,4 Monate gegenüber einer Kontrollgruppe, aber nicht zu einer Verlängerung der Überlebenszeit, siehe Prostatakarzinom Studienergebnisse . In aktuelleren Studien waren die medianen Überlebenszeiten unter Therapie mit Mitoxantron kürzer im Vergleich zu Docetaxel in der Erstlinientherapie und zu Cabazitaxel in der Zweitlinientherapie. Schwere Nebenwirkungen (Grad 3 / 4), die bei mehr als 20 % der Patienten in den randomisierten Studien zur Erstlinientherapie auftraten, waren: Übelkeit / Erbrechen (38 %), Fatigue (35 %) und verminderte linksventrikuläre Ejektionsfraktion (22 %). Die Rate Therapie - assoziierter Todesfälle in der Erstlinientherapie lag bei 0 - 0,3 %, in der Zweitlinientherapie bei 2 %.
5.2.7.6 Estramustin
Estramustin ist ein Kombinationspräparat aus Nitrogenmustard und Östradiol. Es hat hormonelle und zytostatische Wirkung. In der Monotherapie senkt Estramustin den PSA Wert bei bis zu 30 % der Patienten, ohne signifikanten Einfluss auf das progressionsfreie oder das Gesamtüberleben. Belastende Nebenwirkungen sind die Folgen der Hormontherapie mit erhöhter Neigung zu venösen Thrombembolien, kardiovaskulären Komplikationen, peripheren Ödemen und Gynäkomastie sowie Übelkeit und Erbrechen. In Kombinationschemotherapie steigert Estramustin die Ansprechraten und verlängert in der Metaanalyse auch die Zeit zum PSA Progress und die Gesamtüberlebenszeit. Estramustin wird oral appliziert.
5.2.7.7 Cabazitaxel
Cabazitaxel gehört zu den Taxanen. Cabazitaxel wurde als Zweitlinientherapie nach Docetaxel in einer randomisierten klinischen Studie versus Mitoxantron bei Patienten in gutem oder etwas reduziertem Allgemeinzustand (ECOG<2) getestet, siehe Prostatakarzinom Studienergebnisse[18]. Die Remissionsrate (RECIST) lag bei 14,4 %, die PSA Ansprechrate bei 39,2 %. Die mediane Überlebenszeit wurde um 2,4 Monate verlängert. Schwere Nebenwirkungen (Grad 3 / 4), die bei mehr als 5 % der Patienten in der Zulassungsstudie auftraten, waren: Neutropenie (82), Anämie (11) und Diarrhoe (6). Die Rate potenziell Therapie-assoziierter Todesfälle lag bei 5 %, die relativ häufigsten Todesursachen waren Folgen der Neutropenie und kardiale Komplikationen.
5.2.7.8 Andere Substanzen
Ebenfalls zu einem mindestens 50 %igen Rückgang der PSA Werte kommt es unter Chemotherapie mit 5-Fluorouracil (20 %), Platinderivaten (25 %), Vincaalkaloiden (10 %) oder Anthrazyklinen (50 %). Es fehlen Daten zu einer signifikanten Verbesserung klinischer Symptome oder zu einer Verlängerung der Überlebenszeit.
5.2.8 Immuntherapie
Aktuelle Studien zeigen die Wirksamkeit von Behandlungsansätzen zur Stimulation des körpereigenen Immunsystems bei Patienten mit fortgeschrittenem Prostatakarzinom. In Deutschland, in Österreich und in der Schweiz ist die Immuntherapie beim Prostatakarzinom nicht zugelassen.
5.2.8.1 Sipuleucel-T
Diese Vakzine beruht auf derex vivoAktivierung mittels Leukapherese gewonnener autologer Leukozyten mit dem rekombinanten Fusionsprotein PAP-GMCSF (saure Prostataphosphatase und Granulozyten Makrophagen Kolonie - stimulierender Faktor), siehe Prostatakarzinom Studienergebnisse . Die Retransfusion der aktivierten Leukozyten erfolgt dreimal im Abstand von 2 Wochen. Bei asymptomatischen Patienten mit metastasiertem, kastrationsresistenten Prostatakarzinom wurde die Überlebenszeit um 4,1 Monate verlängert. Sipuleucel-T hatte keinen Einfluss auf das progressionsfreie Überleben. Hauptnebenwirkungen Grad 3 und 4 waren Schüttelfrost (1,2 %) und Kopfschmerzen (0,3 %).
5.2.8.2 PROSTVAC-VF
PROSTVAC-VF besteht aus zwei rekombinanten, PSA-Transgene enthaltenden viralen Vektoren und den drei kostimulierenden Molekülen B7.1, ICAM und LFA-3. Die subkutane Applikation der Substanz zusammen mit GM-CSF erfolgt 7mal im Abstand von 2 bzw. 4 Wochen. In einer kleineren, randomisierten Studie wurde die Überlebenszeit von wenig symptomatischen Patienten mit metastasiertem, kastrationsresistentem Prostatakarzinom signifikant verlängert. PROSTVAC-VF hatte keinen Einfluss auf das progressionsfreie Überleben. Ergebnisse größerer klinischer Studien stehen aus.
5.2.9 Knochenmetastasen
Zur Therapie von Patienten mit Knochenmetastasen stehen lokale und systemische Maßnahmen zur Verfügung [2, 7, 19]. Bei Schmerzsymptomatik oder Frakturgefährdung ist die Bestrahlung die Therapie der Wahl. Eine zusätzliche Option ist die operative Versorgung bei pathologischen Frakturen, instabilen Wirbelkörperfrakturen oder als Entlastung bei spinaler Kompression in Verbindung mit einer anschließenden Bestrahlung. Systemische Maßnahmen sind die kausale Therapie und die Gabe von Bisphosphonaten oder dem RANKL Antikörper Denosumab.
Denosumab hat eine höhere Wirksamkeit als Zoledronat. Der Unterschied ist statistisch signifikant, in absoluten Zahlen gering, siehe Studienergebnisse Prostatakarzinom . Bei Patienten mit eingeschränkter Nierenfunktion wird die Gabe von Denosumab empfohlen. Bei Patienten mit guter Wirksamkeit und Verträglichkeit von Bisphosphonaten besteht keine Indikation zum Wechsel der Präparate. Belastende Nebenwirkung dieser medikamentösen osteoprotektiven Maßnahmen sind Kiefernekrosen. Die Inzidenz ist bei den Bisphosphonaten und beim RANKL Antikörper vergleichbar.
5.2.9.1 Bisphosphonate
Positive Studien gibt es zu Zoledronat und Clodronat. Bei Patienten mit kastrationsresistentem Prostatakarzinom führte die Therapie mit Zoledronat zu einer signifikanten Senkung des Risikos ossärer Komplikationen. Bei Patienten mit metastasiertem, hormonsensitivem Prostatakarzinom war die Therapie mit Clodronat mit einer signifikanten Verlängerung der Gesamtüberlebenszeit assoziiert, allerdings ohne signifikanten Einfluss auf die Rate ossärer Komplikationen, siehe Studienergebnisse Prostatakarzinom .Bisphosphonate sind auch indiziert bei Hyperkalzämie. Informationen zum Zulassungsstatus der Bisphosphonate sieheAnhang - Zulassungsstatus von Medikamenten.
5.2.9.2 RANKL - Antikörper
Denosumab ist ein humaner monoklonaler Antikörper, der an den RANK Liganden bindet, dadurch die Aktivierung von RANK verhindert und die Osteoklastenaktivierung inhibiert. In einer multizentrischen Studie bei Patienten mit kastrationsresistentem Prostatakarzinom im Vergleich mit Zoledronat war Denosumab mindestens gleichwertig. Hauptnebenwirkungen sind Hypokalzämie und Kiefernekrosen. Die Gabe von Denosumab ist auch bei eingeschränkter Nierenfunktion möglich.
5.2.9.3 Radionuklide
Alpha-Strahler sind effektiv bei Patienten mit schmerzhaften, ossären Metastasen. In einer aktuellen, großen randomisierten Studie bei Patienten mit kastrationsresistentem Prostatakarzinom und ossären Metastasen wurde jetzt auch ein Überlebensvorteil durch eine Radionuklid-Therapie nachgewiesen, siehe Prostatakarzinom Studienergebnisse . Die mittlere Überlebenszeit von mit223Ra behandelten Patienten war 2,8 Monate länger als in der Kontrollgruppe. In Deutschland, in Österreich und in der Schweiz wird bisher vor allem153Sa eingesetzt.
5.2.10 Weitere, palliative Therapieoptionen
Palliative Therapie beinhaltet die Behandlung körperlicher und psychischer Beschwerden. Sie erfolgt interdisziplinär. Die Notwendigkeit und die Möglichkeiten der Palliativtherapie sollen frühzeitig und umfassend mit allen Betroffenen besprochen werden. Weitere, besonders für die palliative Therapie von Patienten mit fortgeschrittenem Prostatakarzinom geeignete Maßnahmen sind:
5.2.10.1 Steroide
Die Gabe von Steroiden kann relevante Symptome wie Schmerz, Appetitlosigkeit, Müdigkeit und Mangel an Leistungsfähigkeit lindern [7]. Sie führt bei 20 - 50 % der Patienten zu einem Rückgang des PSA Wertes. Geeignet sind Dexamethason, Prednison und Prednisolon.
6 Rehabilitation
Operation, Bestrahlung und systemische Therapie von Patienten mit Prostatakarzinom können zu Therapiefolgestörungen unterschiedlichen Schwergrades führen, die gezielte rehabilitative Maßnahmen im somatischen und psychosozialen Bereich erfordern. Besonders belastend und durch gezielte Maßnahmen behandelbar ist die Harninkontinenz.
Rehabilitationsziele nach radikaler Prostatektomie bzw. nach externer Radiatio sind: Minderung von postradiogenen Funktionsstörungen im Hinblick auf Entleerungsstörungen von Blase und Darm, Verminderung von postoperativen Funktionsstörungen hinsichtlich einer Belastungsharninkontinenz und erektiler Dysfunktion, Wiederherstellung der physischen und psychischen Leistungsfähigkeit, Abbau von Sorgen und Ängsten sowie Information und Beratung .Die Patienten sollen über die Möglichkeiten ambulanter und stationärer Rehabilitationsmaßnahmen sowie weiterer Ansprüche, die sich aus dem Sozialrecht ergeben, frühzeitig informiert werden. Hinsichtlich der Rehabilitationsklinik sollen die Wünsche der Patienten berücksichtigt werden (§9 SGB IX). Dennoch sollte eine Empfehlung für eine Klinik mit onkologischem Schwerpunkt abgegeben werden, um einen optimalen Rehabilitationserfolg zu gewährleisten.
7 Nachsorge
Ziele der Nachsorge sind die frühzeitige Diagnose eines Rezidivs mit dem Ziel der Verlängerung der Überlebenszeit / Erhöhung der Heilungschance, die Erkennung von Nebenwirkungen der Therapie und Vorsorge. Das Ziel einer Verbesserung der Prognose durch strukturierte Nachsorge ist begründet durch die Möglichkeiten der Salvagetherapie bei Lokalrezidiven bzw. die frühzeitige Einleitung einer endokrinen Therapie, siehe Tabelle 6. Die prognostische Relevanz des Nachsorgekonzeptes ist nicht in prospektiven Studien evaluiert.
| Monate |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Anamnese | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X |
PSA | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X |
8 Literatur
Gesellschaft der epidemiologischen Krebsregister in Deutschland / Robert - Koch Institut: Krebs in Deutschland 2005 - 2006, Häufigkeiten und Trends: Darm, 7. Auflage 2010; 36 - 39
AWMF S3 - Leitlinie Prostatakarzinom 2011, http://www.awmf.org/uploads/tx_szleitlinien/043-022-OL-l_S3_Prostatakarzinom_Langfassung_V1-03.pdf
Gallagher DJ, Feifer A, Coleman JA: Genitorurinary cancer predisposition syndromes. Hematol Oncol Clin N Am 24:861-883, 2010. DOI:10.1016/j.hoc.2010.06.002
Herkommer K, Schmidt C, Gschwend JE: Zehn Jahre nationales Forschungsprojekt “Familiäres Prostatakarzinom“. Urologe 2011. DOI: 10.1007/s00120-011-2552-4
Klein EA, Thompson IM: Chemoprevention of prostate cancer: an updated view. World J Urol published online, 2012.DOI: 10.1007/s00345-011-0822-9
Wilt TJ, MacDonald R, Hagerty K et al.: 5-alpha-reductase inhibitors for prostate cancer prevention. Cochrane Collaboration CD007091, 2011.
European Association of Urology: Guidelines on Prostate cancer 2011
Ilic D, O’Connor D, Green S, Wilt TJ: Screening for prostate cancer (Review).Cochrane Database of Systematic Reviews 2006 (Update 2010): Issue 3. Artn No.: CD004720. DOI: 10.1002/14651858.CD004720.pub2
Sobin LH, Gospodariwicz M, Wittekind C (Eds): TNM classification of malignant tumors. UICC International Union Against Cancer. 7th ed. Wiley-Blackwell: 243-248, 2009. http://www.uicc.org/tnm/ oderISBN 978-1-4443-3241-4 .
Pallis AG, Ring A, Fortpied C et al.: EORTC workshop on clinical trial methodology in older individuals with a diagnosis of solid tumors. Ann Oncol 22:1922-1926, 2011. DOI: 10.1093/annonc/mdq687
Klotz L, Zhang L, Lam A et al.: Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 28:126-131, 2010.DOI:10.1200/JCO.2009.24.2180
D’Amico AV: Risk-based management of prostate cancer. N Engl J Med 365:169-171, 2011.PMID: 21751910
Bill-Axelson A, Homberg L, Ruutu M et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 364:1708-1717, 2011.PMID: 21542742
Loblaw DA, Virgo KS, Nam R et al.: Initial hormonal management of androgen-sensitive, metastatic, recurrent or progressive prostate cancer: 2006 update of an American Society of Oncology practice guideline. J Clin Oncol 25:1596-1605, 2007.DOI: 10.1200/JCO.2004.04.579
Prostate Cancer Trialists’ Collaborative Group: Maximum androgen blockade in advanced prostate cancer: an overview of the randomized trials. Lancet 355:1491-1498, 2000.PMID: 10801170
Saylor PJ, Lee RJ, Smith MR:Emerging therapies to prevent skeletal morbidity in men with prostate cancer. J Clin Oncol 29:3705-3714, 2011.DOI: 10.1200/JCO.2010.34.4994
- Tannock IF, de Wit R, Berry WR et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 351:1502-1512, 2004. PMID: 15470213
- De Bono JS, Oudard S, Ozguroglu M et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomized open-label trial. Lancet 376:1147-1154, 2010. PMID: 20888992
- Saylor PJ, Lee RJ, Smith MR: Emerging therapies to prevent skeletal morbidity in men with prostate cancer. J Clin Oncol 29:3705-3714, 2011. DOI: 10.1200/JCO.2010.34.4994
9 Aktive Studien
10 medikamentöse Tumortherapie - Protokolle
11 Zulassungsstatus von Medikamenten
Prostatakarzinom - Zulassungsstatus von Medikamenten - Endokrine Therapie
12 Studienergebnisse Prostatakarzinom
Prostatakarzinom Studienergebnisse (randomisierte Phase II Studien, Phase III Studien, Metaanalysen)
13 Links
Bundesverband Prostatakrebs Selbsthilfe,www.prostatakrebs-bps.de
14 Anschriften der Verfasser
Download
Reference:
Quellenangabe:
Onkopedia-Leitlinien werden kontinuierlich an den Stand des Wissens angepasst. Die jeweils gültige Version, AGB und Nutzungsbedingungen finden Sie unter www.onkopedia.com.
Für die kommerzielle Nutzung wenden Sie sich bitte an onkopedia@dgho.de.
Onkopedia guidelines are continuously adapted to the state of knowledge. The currently valid version, terms of use and general terms and conditions can be found at onkopedia-guidelines.info.
For commercial use, please contact onkopedia@dgho.de.




