Frühe Nutzenbewertung - Olaparib / Bevacizumab in der Erhaltungstherapie des HRD+ Ovarialkarzinoms
Die erneute Nutzenbewertung der Kombination Olaparib (Lynparza) / Bevacizumab wird nach Ablauf der am Juni 2021 festgesetzten Befristung durchgeführt. Im Erstverfahren hatte der G-BA die Festlegung „Zusatznutzen nicht belegt“ getroffen. Olaparib ist zugelassen in Kombination mit Bevacizumab für die Erhaltungstherapie von Patientinnen mit einem fortgeschrittenen (FIGO-Stadien III und IV) high-grade epithelialem Ovarialkarzinom, Eileiterkarzinom oder primären Peritonealkarzinom, und partieller oder kompletter Remission nach einer Platin-basierten Erstlinien-Chemotherapie in Kombination mit Bevacizumab. Voraussetzung für die Anwendung von Olaparib / Bevacizumab ist der Nachweis einer homologen Rekombinations-Defizienz (HRD), definiert durch eine BRCA1/2-Mutation und/oder genomische Instabilität. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
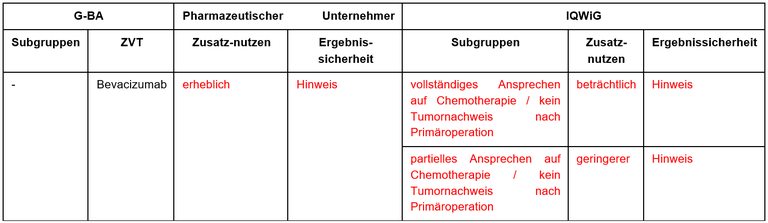
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Der von uns im folgenden verwendete Terminus „Ovarialkarzinom“ umfasst die gesamte Indikation „high-grade epitheliales Ovarialkarzinom, Eileiterkarzinom oder primäres Peritonealkarzinom“.
- Die vom G-BA festgelegte, zweckmäßige Vergleichstherapie (ZVT) mit Bevacizumab entspricht den Leitlinien und dem Kontrollarm der Zulassungsstudie.
- Basis der frühen Nutzenbewertung ist PAOLA-1, eine prospektive, internationale, randomisierte, Placebo-kontrollierte Studie mit einer 2:1 Randomisierung zugunsten des Olaparib / Bevacizumab-Arms. Eingeschlossen wurden alle Patientinnen, unabhängig vom Nachweis von BRCA1/2-Mutationen und/oder HRD.
- Olaparib / Bevacizumab führte bei HRD+ Patientinnen zur signifikanten Verlängerung der progressionsfreien und der Gesamtüberlebenszeit. Der Einfluss auf die Gesamtüberlebenszeit ist besonders bemerkenswert angesichts des hohen „Crossover“ mit Einsatz von PARPi im Kontrollarm bei Rezidiv/Progress.
- Die Rate schwerer Nebenwirkungen entspricht dem Substanzklassenspektrum von PARP-Inhibitoren (PARPi) und von Bevacizumab. Die Rate von Therapieabbrüchen aufgrund von Nebenwirkungen lag bei 19,6% im Olaparib / Bevacizumab- versus 6,1% im Bevacizumab-Arm.
Die Ergebnisse der finalen Datenanalyse bestätigen die früheren Ergebnisse der Zulassungsstudie. Olaparib / Bevacizumab ist Bestandteil der Versorgung bei diesen Patientinnen.



