Frühe Nutzenbewertung - Eftrenonacog alfa bei Hämophilie B
Die erneute Nutzenbewertung von Eftrenonacog alfa (Alprolix®) wird nach Überschreiten der gesetzlich festgelegten Umsatzschwelle für Arzneimittel mit Orphan-Drug-Status durchgeführt. Eftrenonacog alfa (Alprolix®) ist zugelassen für die Therapie und Prophylaxe bei Patienten mit Hämophilie B. Das IQWiG wurde mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
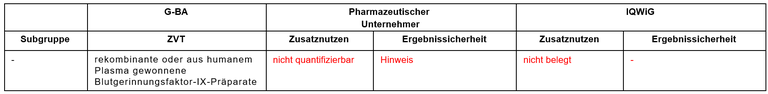
pU – pharmazeutischer Unternehmer; ZVT – zweckmäßige Vergleichstherapie;
Unsere Anmerkungen sind:
- Eftrenonacog alfa hat einen Orphan-Drug-Status. Die jetzt für die Neubewertung festgelegte Vergleichstherapie entspricht dem Stand des Wissens und der Versorgung. Die 2023 neu zugelassene Gentherapie der Hämophilie B ist bisher nicht flächendeckend eingeführt.
- Eftrenonacog alfa ist ein hoch wirksames rekombinantes Faktor-IX (FIX)-Präparat für Patienten mit substitutionspflichtiger Hämophilie B. Besonderheit ist die längere Halbwertszeit.
- Bei Prophylaxe-Intervallen von 7-16 Tagen oder bei einer individualisierten Prophylaxe liegen die annualisierten Blutungsraten niedrig.
- Die Lebensqualität der Patienten ist hoch.
- Abweichend vom ersten Dossier wurde jetzt die Bildung von niedrigtitrigen Anti-FIX-Antikörpern bei einem Patienten beobachtet.
Die Anforderungen der Zulassungsbehörden unterscheiden sich bei Gerinnungspräparaten erheblich von der Methodik der Nutzenbewertung. Der Zusatznutzen von Eftrenonacog alfa liegt in der Möglichkeit der Verlängerung der Infusionsintervalle. Mangels direkt vergleichender Studien ist der Zusatznutzen von Eftrenonacog alfa nicht zuverlässig quantifizierbar.



