Frühe Nutzenbewertung - Luspatercept bei Myelodysplastischen Neoplasien
Diese erneute Nutzenbewertung von Luspatercept (Reblozyl®) bei Patientinnen und Patienten (Pat.) mit transfusionsabhänger Anämie bei Myelodysplastischen Neoplasien (MDS) wird nach Überschreitung der gesetzlich festgelegen Umsatzgrenze für seltene Erkrankungen durchgeführt. Luspatercept ist zugelassen zur Behandlung von Pat. mit transfusionsabhängiger Anämie aufgrund eines MDS mit Ringsideroblasten (MDS-RS), die auf eine Erythropoetin-basierte Therapie nicht zufriedenstellend angesprochen haben oder dafür nicht geeignet sind, und ein sehr niedriges, niedriges oder intermediäres Risiko zur Transformation in eine Akute Myeloische Leukämie (AML) haben. Im ersten Verfahren war ein nicht quantifizierbarer Zusatznutzen festgelegt worden. Auch in diesem erneuten Verfahren hat der G-BA keine Subpopulationen gebildet. Das IQWiG wurde mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
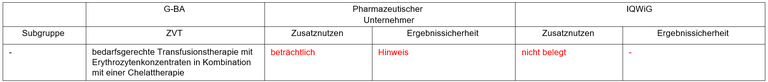
pU – pharmazeutischer Unternehmer; ZVT – zweckmäßige Vergleichstherapie;
Unsere Anmerkungen sind weitgehend identisch mit der Stellungnahme im ersten Verfahren:
- Standard in der Therapie der transfusionspflichtigen Anämie bei Pat. mit MDS-RS nach Versagen von Erythropoese-stimulierenden Faktoren (ESF) ist die regelmäßige Gabe von Erythrozytenkonzentraten. Dem entspricht die zweckmäßige Vergleichstherapie (ZVT). Die Ergänzung der ZVT mit einer „obligaten“ Gabe von Eisenchelatoren entspricht nicht der Versorgung, in der Zulassungsstudie wurden Eisenchelatoren bei etwa 50% der Pat. eingesetzt.
- Basis der frühen Nutzenbewertung von Luspatercept ist MEDALIST, eine multizentrische, randomisierte, Placebo-kontrollierte Phase-III-Studie. Die Pat. wurden 2:1 zugunsten des Verum-Arms randomisiert.
- Luspatercept führte zu einer signifikanten Senkung der Transfusionslast.
- Die Lebensqualität wurde durch Luspatercept nicht verbessert.
- Die Nebenwirkungsrate ist unter Luspatercept erhöht. Häufiger unter Luspatercept auftretende Nebenwirkungen sind u. a. Fatigue, Diarrhoe und Übelkeit.
Luspatercept führt zu einem Anstieg des Hämoglobingehaltes und zur Reduktion der Transfusionsbedürftigkeit. Der von den behandelnden ÄrztInnen erlebte Gewinn an Lebensqualität wird durch die in der Zulassungsstudie eingesetzten Fragebögen nicht erfasst. Ebenfalls nicht erfasst wird der nachhaltige Einfluss auf die Reduktion der sekundären Hämochromatose sowwie die Schonung der wertvollen Ressource der Erythrozytenkonzentrate.
Pat. mit MDS-RS (<5% KM-Blasten, ≥15% Ringsideroblasten im KM bzw. ≥5% Ringsideroblasten im KM und Mutation von SF3B1) und einer transfusionsbedürftigen Anämie sollten mit Luspatercept behandelt werden, wenn Sie auf ESF nicht angesprochen haben oder keine hohe Wahrscheinlichkeit des Ansprechens aufweisen.




