Frühe Nutzenbewertung - Selpercatinib beim fortgeschrittenen RET+ Schildddrüsenkarzinom
1. Medulläres Schilddrüsenkarzinom
Die frühe Nutzenbewertung von Selpercatinib (Retsevmo®) ist ein weiteres Verfahren beim medullären Schilddrüsenkarzinom (MTC). Selpercatinib ist zugelassen bei Erwachsenen und Jugendlichen (ab 12 Jahre) mit fortgeschrittenem MTC, Nachweis einer RET-Mutation im Tumorgewebe oder in der Keimbahn, und Vorbehandlung mit Cabozantinib und/oder Vandetanib. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
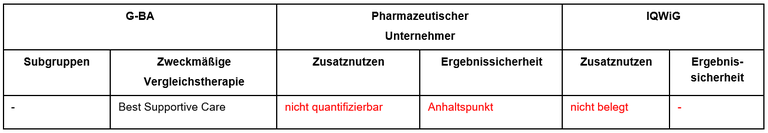
Unsere Anmerkungen sind:
- Die Festlegung der ZVT entspricht nur teilweise dem Stand der Versorgung. Dieser ist:
- nach Therapie mit Cabozantinib Vandetanib
- nach Therapie mit Vandetanib Cabozantinib
- nach Therapie mit Cabozantinib und / oder Vandetanib Best Supportive Care
Die Fachgesellschaften waren in die Beratung zur Festlegung der Zweckmäßigen Vergleichstherapie nicht eingebunden.
- Basis der frühen Nutzenbewertung ist LIBRETTO-001, eine offene, internationale, multizentrische Phase-1/2-Basket-Studie. Beim fortgeschrittenen/metastasierten MTC wurden Patient*innen mit Nachweis einer RET-Mutation eingeschlossen, im Hinblick auf die Zulassung ist die Kohorte nach Vorbehandlung mit Cabozantinib und/oder Vandetanib relevant.
- Selpercatinib führte bei etwa zwei Drittel der Patient*innen zu einer objektiven Remission. Die mediane progressionsfreie Überlebensrate nach 24 Monaten lag bei etwa 70%, die Gesamtüberlebensrate nach 24 Monaten bei etwa 80%.
- Die Rate schwerer Nebenwirkungen ist niedriger als bei Therapie mit Cabozantinib oder Vandetanib.
- Selpercatinib hat eine hohe Wirksamkeit bei ZNS Metastasen.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Selpercatinib den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
- Die Aussagen zur Wirksamkeit und zum Einsatz von Selpercatinib treffen auch auf Kinder und Jugendliche ab 12 Jahre zu.
Selpercatinib ist das erste, gezielt wirksame Arzneimittel beim RET-mutierten MTC. Die aktuell vorliegenden Daten zeigen hohe Ansprechraten und nachhaltige Remissionen bei vorbehandelten Patient*innen.
2. Differenziertes oder anaplastisches, Radiojod-refraktäres Schilddrüsenkarzinom
Die frühe Nutzenbewertung von Selpercatinib (Retsevmo®) beim RET-fusionspositiven (RET+) Schilddrüsenkarzinom wird zeitgleich mit dem Verfahren zur frühen Nutzenbewertung von Selpercatinib beim RET-mutierten, medullären Schilddrüsenkarzinom (MTC) durchgeführt. Selpercatinib ist zugelassen bei Patient*innen mit fortgeschrittenem Schilddrüsenkarzinom nach Vorbehandlung mit Sorafenib oder Lenvatinib. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
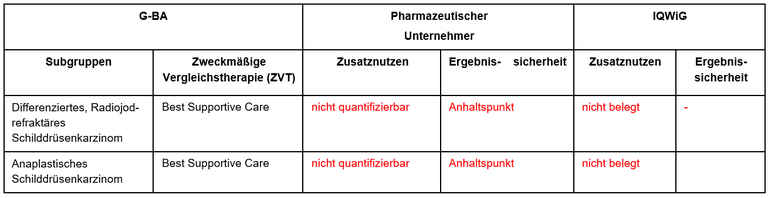
Unsere Anmerkungen sind:
- Die Festlegung der ZVT entspricht für das differenzierte Radiojod-refraktäre Schilddrüsenkarzinom nicht dem Standard der Versorgung. Dieser ist:
- nach Therapie mit Lenvatinib Sorafenib
- nach Therapie mit Sorafenib Lenvatinib
- nach Therapie mit Lenvatinib und/oder Sorafenib Best Supportive Care
- bei Nachweis von NTRK-Genfusionen Entrectinib oder Larotrectinib
Für das anaplastische Schilddrüsenkarzinom sind weder Sorafenib noch Lenvatinib zugelassen. Behandlungsstandard sind hier die Radiochemotherapie bzw. bei Nachweis von NTRK-Genfusionen der Einsatz von Entrectinib oder Larotrectinib. Patient*innen mit anaplastischem Schilddrüsenkarzinom wurden in der Zulassungsstudie nicht behandelt. Entsprechend ist die Sinnhaftigkeit der Bildung von zwei Subgruppen (differenziert, anaplastisch) angesichts der insgesamt sehr kleinen Patientengruppe fraglich, findet sich auch nicht in den Zulassungsbedingungen. Die Fachgesellschaften waren in die Beratung zur Festlegung der Zweckmäßigen Vergleichstherapie nicht eingebunden.
- Basis der frühen Nutzenbewertung ist LIBRETTO-001, eine offene, internationale, multizentrische Phase-1/2-Basket-Studie. Die Subgruppe mit fortgeschrittenem bzw. metastasiertem Schilddrüsenkarzinom umfasst 19 Patient*innen, der Altersmedian lag bei 53 Jahren.
- Selpercatinib führte bei etwa 80% der Patient*innen zu einer Remission. Die mediane progressionsfreie Überlebensrate nach 24 Monaten lag bei 30%, die Gesamtüberlebensrate bei 70%.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Selpercatinib den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
In der Therapie von Patient*innen mit fortgeschrittenem bzw. metastasiertem, differenziertem oder anaplastischem Schilddrüsenkarzinom besteht ein großer, ungedeckter medizinischer Bedarf. Selpercatinib ist eine neue, hoch wirksame und gut verträgliche Option bei Patienten mit RET-alteriertem Schilddrüsenkarzinom.



