Frühe Nutzenbewertung - Fidaxomicin bei Kindern und Jugendlichen mit Clostridioides-difficile-Infektion
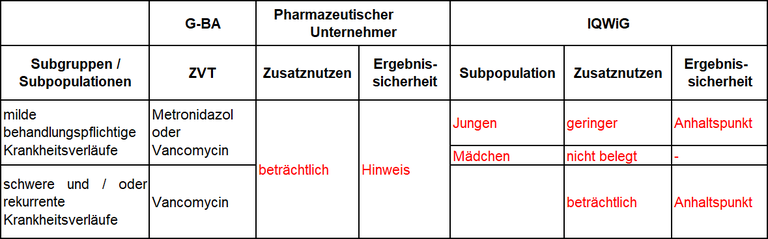
Zur Festlegung der zweckmäßigen Vergleichstherapie hat der G-BA zwei Subgruppen nach dem Schweregrad der Erkrankung gebildet, und das IQWiG mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Clostridioides-difficile-Infektionen (CDI) und Clostridioides-difficile-assoziierte Diarrhoen (CDAD) sind auch in der pädiatrischen Onkologie und Hämatologie eine relevante Komplikation unter intensiver Chemotherapie oder im Rahmen einer Stammzelltransplantation. Die vom G-BA festgelegte ZVT entspricht dem aktuellen Standard.
- Basis dieser Nutzenbewertung ist die multizentrische, randomisierte Phase-III-Studie SUNSHINE an 148 Kindern und Jugendlichen. 44% der Patienten hatten eine maligne Grunderkrankung.
- Fidaxomicin ist dem Vancomycin in der Heilungsrate aller Patienten und bei Patienten mit Clostridioides-difficile-Infektion nummerisch überlegen, besonders deutlich ist der Unterschied bei Patienten mit schwerem Krankheitsverlauf.
- Fidaxomicin führt auch zu einer Senkung der Rezidivrate.
- Schwächen der Zulassungsstudie liegen in der Heterogenität des Patientenkollektivs, dem Design (Überlegenheit? Nicht-Unterlegenheit?) und dem „studienspezifischen“ primären Endpunkt, der nicht mit dem primären Endpunkt der vorherigen Studien zu Fidaxomicin identisch ist.
- Die vom IQWiG identifizierte, gesteigerte neurologische Toxizität bei Patienten mit schwerem Verlauf wird vom pU nicht thematisiert. Klinisch ist uns eine relevante neurologische Toxizität unter Fidaxomicin bisher nicht aufgefallen. Die Diskrepanz muss geklärt werden.
- Der vom IQWiG identifizierte, geschlechtsspezifische Unterschied in der Wirksamkeit von Fidaxomicin wurde bisher nicht beschrieben, in der Versorgung nicht beobachtet und ist vermutlich durch niedrige Ereigniszahlen bedingt.
Der größte ungedeckte medizinische Bedarf besteht bei Kindern und Jugendlichen mit schwerem Verlauf und bei Rezidiven mit schwerer klinischer Symptomatik. Hier besteht ein deutlicher Vorteil von Fidaxomicin gegenüber Vancomycin. Fidaxomicin ist eine Bereicherung der therapeutischen Optionen bei Kindern und Jugendlichen mit schwerer CDI. Aufgrund der niedrigen Fallzahlen in den pädiatrischen Zentren ist ein Register sinnvoll.




